- ·
- circRNA qPCR检测
- 产品介绍
- 结果展示
- FAQ
基于qPCR检测技术的circRNA表达与差异分析是对测序、芯片结果的有效补充和验证。
吉赛生物根据circRNA的闭合环形结构,针对其接头序列设计Divergent primers。引物经过多方面严格的验证,可用于检测细胞、组织、血液和外泌体等多种样本中circRNA差异表达情况。
技术优势
1. 准确性:针对circRNA拼接位点,设计跨接头引物,即便在相应线性RNA存在的情况下也能特异性检测circRNA,使circRNA的检测准确可靠。
2. 特异性:每一对特异引物都经过严格验证,熔解曲线均呈单峰,电泳均呈单一条带,扩增产物与目的基因相符。
项目明细
1. 引物设计及合成;
2. RNA抽提+逆转录(细胞、组织、血清/尿液/其他特殊样品); Exosome提取(血清血浆、细胞上清、尿液/体液);
3. qPCR三次重复,含内参。
客户提供
circRNA ID/物种/全长、qPCR检测样品等。
交付标准
1. 详细的qPCR检测报告;
2. 定制化设计的qPCR引物;
3. 赠送:1OD通用内参引物。
结果示例
1.RNA的16s 26s 条带清晰无降解
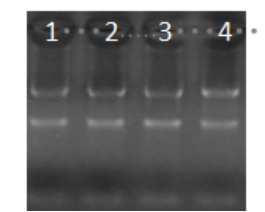
图1.RNA质检
1. 血清/血浆及其外泌体样本是否可以进行circRNA qPCR检测?
可以。血清/血浆及其外泌体样本中的RNA片段化程度较高,大小在200nt以上的RNA含量少,浓度低,1ml血清/血浆提取出来的RNA只有1-10ng左右。因此,最好选用2ml以上半年内收集的无反复冻融的血清/血浆样本,并且最好选择本身表达量高或者circbase上评分高的circRNA进行qPCR检测。
2. 做circRNA逆转录的时候,是否可以单独用Oligo(dT)引物来逆转?
不可以。circRNAs是一类不具有5' 末端帽子和3' 末端poly(A)尾巴,并以共价键形成环形结构的非编码RNA分子。
3. RNA的降解是否可以通过OD比值来判断?
不能,RNA有没有降解可以通过凝胶电泳或者Aligent 2100仪器来判断,OD值只能判断RNA的纯度。
4. qPCR两步法和三步法有什么区别?
两步法采用退火与扩增相同温度,这样引物二聚体和错配等扩增干扰较少,特异性高,因此两步法特异性高;而三步法多了一步延伸,使得反应完全以提高扩增产量,因此三步法扩增效率高。
5. circRNA qPCR产物测序后,如何查找环化位点?
circRNA qPCR产物测序查找环化位点分两种情况:
a.如果是跨环化位点设计的引物,若上游引物设计在环化位点处,用下游引物去测序,查看测序结果时要先把序列反向互补后再去查找环化位点;若下游引物设计在环化位点处,则用上游引物去测序,直接查找环化位点;
b.如果设计的是背靠背的引物,上下游引物都可以测序,建议用离环化位点远的一条引物测序。同理,若用上游引物测序,直接查找环化位点;若用下游引物测序,查看测序结果时要先把测序序列反向互补再去查找环化位点。
6. qPCR定量方法的绝对定量和相对定量有什么区别?
绝对定量和相对定量的区别在于绝对定量的目的是测定目的基因在样本中的分子数目,即通常所说的拷贝数。相对定量的目的是测定目的基因在两个或多个样本中的含量的相对比例,而不需要知道它们在每个样本中的拷贝数。绝对定量实验必须使用已知拷贝数的绝对标准品,必须做标准曲线。相对定量可以做标准曲线,也可以不做标准曲线。

 购物车
购物车



 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn