- ·
circRNA过表达载体
- 产品介绍
- 案例分析
- 客户文章
- 说明书下载
- Q&A
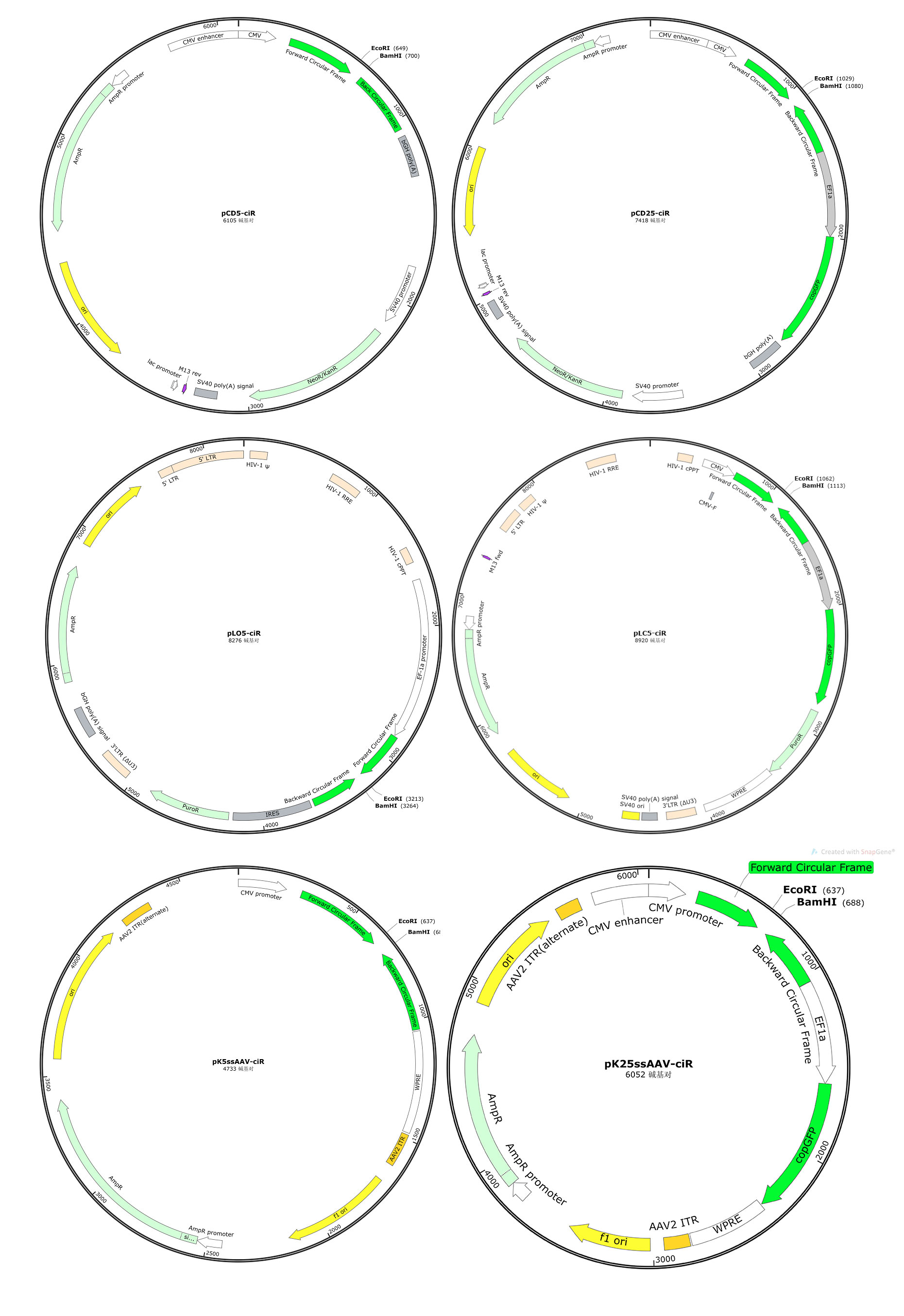
第五代circRNA过表达载体有pCD5-ciR、pCD25-ciR、pLO5-ciR、pLC5-ciR、pK5ssAAV-ciR和pK25ssAAV-ciR,能满足普通真核表达、慢病毒包装和腺相关病毒(AAV)包装等多种用途。载体均携带优化过的侧翼成环框架,含有精心改造的Alu元件、QKI等RBP的结合位点,并使用全新设计的环化介导序列,能保证插入的circRNA准确高效环化。
第五代circRNA过表达载体的主要特点
1.环化准确性更高。全新设计的成环框架和环化介导序列,在保证高效率过表达的前提下环化准确性更高,比上代载体准确环化成功率提高60%。
2.稳定性更高。对长度小于200 nt或大于2000 nt的circRNA准确高效过表达成功率更高,比上代载体成功率提高30%。
3.通用性更强。提升对非天然circRNA序列的支持,插入任意一段序列也可以准确高效成环,比上代载体成功率提高50%。
4.可移植性更高。6个载体全部预留最常用的EcoRI和BamHI酶切位点,不同载体间转换更方便。
无GFP GFP 真核表达载体 GENESEED®pCD5-ciR GENESEED®pCD25-ciR 只瞬时表达 慢病毒表达载体 GENESEED®pLO5-ciR GENESEED®pLC5-ciR 可稳定/瞬时表达 AAV表达载体 GENESEED®pK5ssAAV-ciR GENESEED®pK25ssAAV-ciR 可稳定/瞬时表达 吉赛推出了升级的第五代circRNA过表达载体,有pCD5-ciR、pCD25-ciR、pLO5-ciR、pLC5-ciR、pK5ssAAV-ciR和pK25ssAAV-ciR,使用时只需要克隆circRNA的序列(线性化)进载体中,和常规的载体构建一模一样,相对简便省事。能满足普通真核表达、慢病毒包装和腺相关病毒(AAV)包装等多种用途,优点有环化准确性更高、稳定性更高、通用性更强和可移植性更高。
案例1

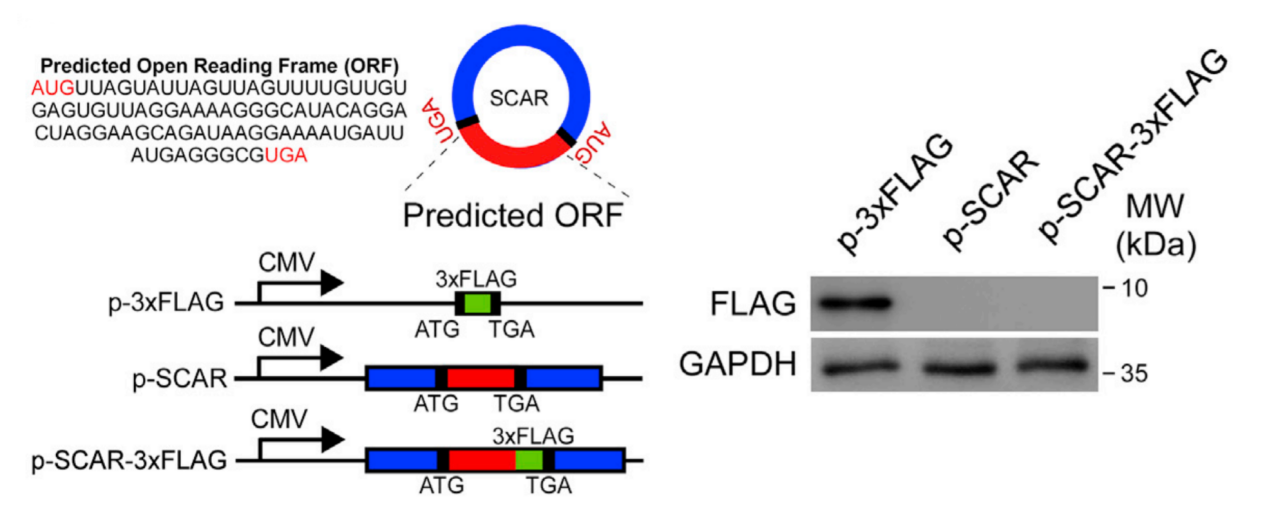
2020年9月14日,中山大学孙逸仙纪念医院苏士成教授合作团队在Cell杂志(IF 41.584)上发表了题为Targeting Mitochondria-Located circRNA SCAR Alleviates NASH via Reducing mROS Output的文章,该文章应用Arraystar Human CircRNA芯片筛选鉴定出与非酒精性脂肪性肝炎发生相关的环状RNA分子SCAR,并发现在线粒体中过表达circRNA SCAR能够抑制肝脏成纤维细胞的活化与相应的炎症反应,敲低则有相反的表型。并且作者使用吉赛公司过表达载体 pcD-ciR 通过插入3×flag标签以及预测的ORF序列(图1),发现circRNA SCAR无法编码蛋白质,随后作者通过一系列实验发现该circRNA能够直接与ATP5B结合并发挥生物学功能[1]。作者团队发现了线粒体circRNA的重要功能并发展了一系列相关的实验方法,为免疫代谢疾病提供了一种有吸引力的治疗策略。
案例2
南京医科大学王美林教授,杜牧龙副教授和刘凌翔主任医师共同通讯在Molecular Cancer杂志在线发表文章Exosomal circLPAR1 functions in colorectal cancer diagnosis and tumorigenesis through suppressing BRD4 via METTL3–eIF3h interaction,本研究强调了血浆外泌体中的circLPAR1在结直肠癌诊断中是一个有前途的预测因子,并描述了其对结直肠癌发生的生物学调节。为临床早期诊断和疾病发展的发病机制研究提供了新的视角。

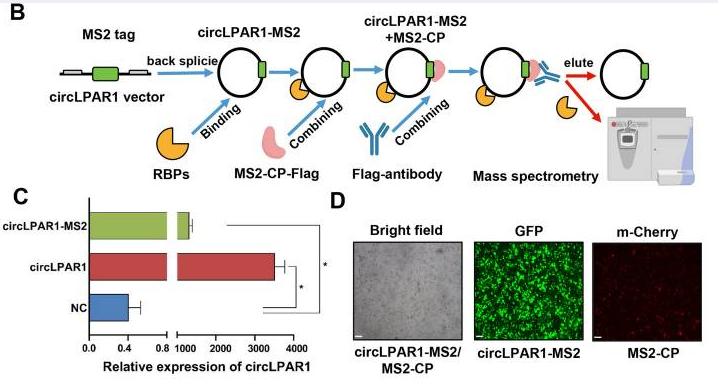
图1. 使用 MS2 标记系统的 circLPAR1 下拉实验
本研究中,作者使用circRNA pull-down技术进行circRNA下拉试验,进而对下拉蛋白产物进行质谱分析。CircRNA pull-down技术是使用带有MS2捕获蛋白(MS2-CP)的circRNA下拉分析来确定与circLPAR1相关的RNA结合蛋白(RBPs)。如图2所示,该技术是在吉赛生物专利技术circRNA过表达载体基础上,将RNA标签体系引入circRNA中,通过RNA标签和捕获蛋白的高度特异且稳定相互作用,进行靶分子捕获和相互作用分子的捕获。[2]
案例解析参考文献:
[1] Qiyi Zhao, Jiayu Liu, Hong Deng, et al. Targeting Mitochondria-Located circRNA SCAR Alleviates NASH via Reducing mROS Output.Cell (2020), https://doi.org/10.1016/j.cell.2020.08.009
[2] Shanyue Tan, et al. Exosomal circLPAR1 functions in colorectal cancer diagnosis and tumorigenesis through suppressing BRD4 via METTL3–eIF3h interaction Mol Cancer.(2022); doi: 10.1186/s12943-021-01471-y
1、Qiyi Zhao, Jiayu Liu, Hong Deng, et al. Targeting Mitochondria-Located circRNA SCAR Alleviates NASH via Reducing mROS Output.Cell (2020), https://doi.org/10.1016/j.cell.2020.08.009
2、Rui Zheng,#1,2 Ke Zhang,#3 Shanyue Tan, et al. Exosomal circLPAR1 functions in colorectal cancer diagnosis and tumorigenesis through suppressing BRD4 via METTL3–eIF3h interaction Mol Cancer.( 2022); doi: 10.1186/s12943-021-01471-y
-
1、circRNA过表达怎么做?
CircRNA的形成和线性RNA不同,因此对circRNA的过表达不能直接将序列连接到常规的真核表达载体(如pcDNA3.1)来进行。已明确的circRNA形成依赖于侧翼序列中的反向互补序列(RCMs,如Alu元件)或与能调控circRNA生成的蛋白(如QKI)的结合位点,因此构建载体时可以在circRNA序列上下游分别增加一段反向互补的序列,质粒转染细胞后会先转录出上游+circRNA+下游的线性RNA链,再依靠长下游的反向互补配对促使成环。
2、 circRNA过表达成功标准?
载体构建好后瞬时转染细胞进行RT-PCR检测以验证过表达效率。
1)qPCR检测有过表达倍数,质粒瞬转效率高,基因本底丰度不太高的话一般都可以过表达50倍以上;
2)使用Divergent引物检测过表达的PCR产物是大小正确的单一条带,PCR产物进行sanger测序确定成环序列准确。满足这两个条件才可以认为载体实现了对circRNA的准确高效率过表达。
填写需求描述给我们
工具快速咨询
400-8989-400
geneseed@geneseed.com.cn

 购物车
购物车





 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn