- ·
ChIP试剂盒
- 产品介绍
- 案例分析
- 说明书下载
- Q&A
转录是遗传信息从DNA到RNA传递的关键步骤,也是RNA生物合成的最主要形式。转录因子(transcription factor)是一类能与基因5’端特定序列专一性结合,使目的基因以特定的强度在特定的时间与空间表达的蛋白质分子,是参与转录调控的关键因素之一。
染色质免疫沉淀(Chromatin immunoprecipitation,ChIP)是一种分析 DNA 与蛋白质相互作用的研究方法。它的基本原理是活细胞或新鲜组织经过交联方式锁定核蛋白(转录因子、DNA损伤修复蛋白、组蛋白或DNA修饰酶、读取酶、去修饰酶等)与靶基因互作关系,再利用超声波物理法或生物酶法使染色质片段化,最后用核蛋白的特异性抗体,通过免疫结合的方式富集核蛋白所结合的 DNA 片段。核蛋白结合DNA片段分离纯化后,可以进行定量qPCR或高通量测序等分析。
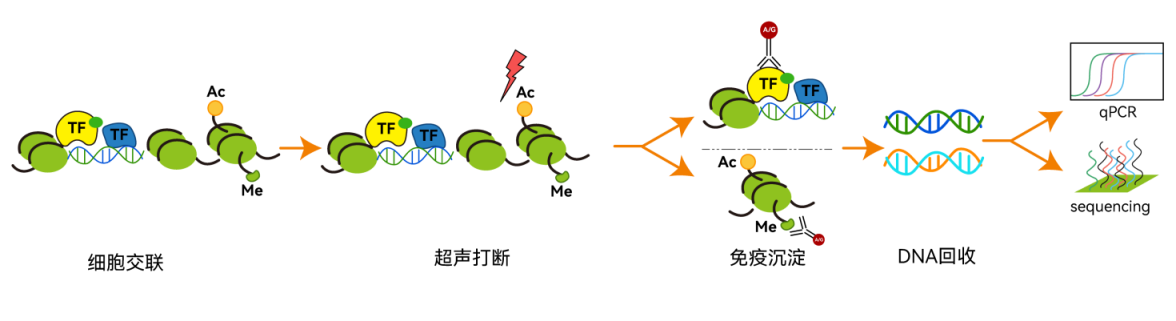 ChIP技术原理图
ChIP技术原理图应用范围
1. 验证已知蛋白-DNA相互作用;
2. 研究转录因子的靶向基因及结合位点;
3. 研究DNA/RNA聚合酶、转录复合物在基因组上的作用位点;
4. 研究组蛋白共价修饰与基因表达的关系。
产品优势
① 胞内反应:使用抗体免疫沉淀胞内蛋白-DNA复合物,真实反应细胞生理状态;
② 流程简便:操作简便;
③ 时间周期短:整个实验流程<8h。
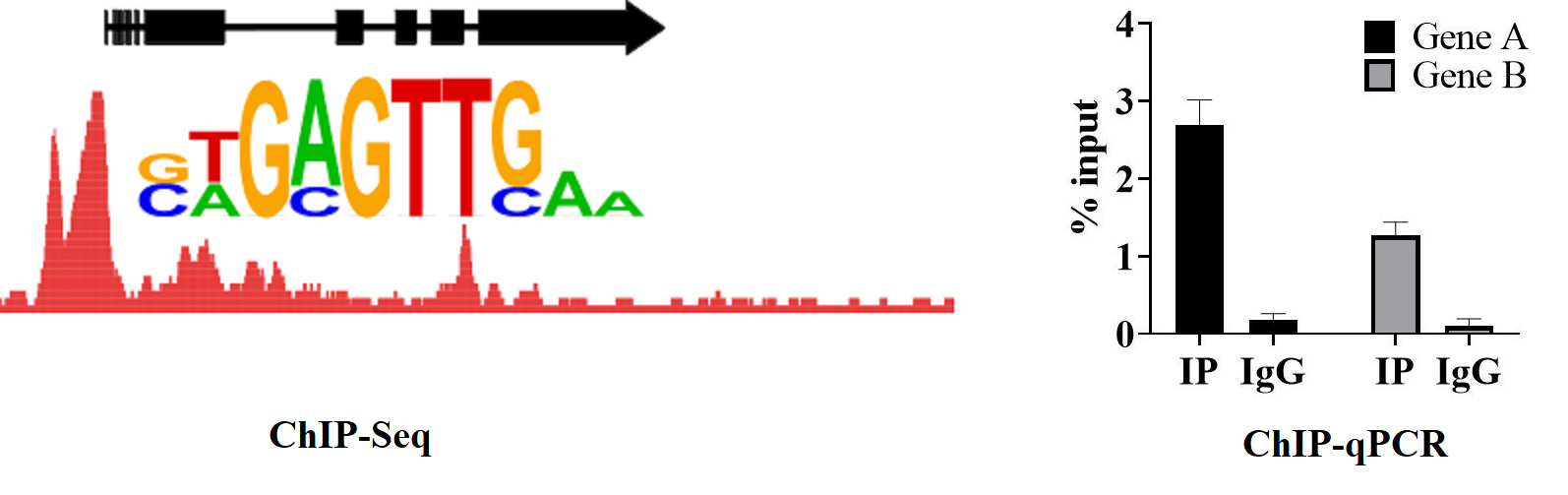
问:ChIP实验完成之后,IP、IgG组别之间的CT值差异不大,是什么原因?
答:IP组CT值在28可能有以下几种原因或之一:①样本量不够;②检测基因非转录因子靶基因;③ 抗体效价低;④ 抗体非ChIP级别;⑤引物设计问题。
问:10e6的样本量是否能够开展ChIP实验?
答:不推荐,受特定时期转录因子发生转录激活的几率较低的影响,需要10e7细胞才能开展实验。
问:ChIP实验的阴阳性对照如何选择,实验是否阴阳性对照是必须的?
答:阴性靶基因可以选择GAPDH或ACTB,但是阳性靶基因受细胞类型,生理状态机药物干预等因素影响,没有办法统一,推荐查阅文献报道;推荐增加阴阳性对照检测,但不必须。
问:ChIP产物浓度一般什么范围?
答:ChIP产物总量及浓度受转录因子表达水平、靶基因数量及细胞状态等诸多因素影响,所以没有统一的标准,一般总量在1 ~ 200ng范围内。
问:ChIP产物浓度较低,超微量分光光度计无法检测,是实验失败了吗?
答:ChIP产物总量及浓度受转录因子表达水平、靶基因数量及细胞状态等诸多因素影响,产物总量一般较低,超微量分光光度计的检测范围在10 ~ 1000 ng范围,超出检测范围就会无法检测,推荐以qPCR检测为准。
问:无ChIP级别抗体,IP级别抗体能否开展ChIP实验?
答:IP级别抗体理论上可以开展ChIP实验,建议实验前先经过CoIP验证抗体能否工作;
问:关键设备是什么,超声破碎步骤是否必须,有探头与无探头的超声破碎仪如
何选择?
答:基因组需要经超声打断后方可开展染色质免疫共沉淀,有探头与无探头的超声破碎仪主要的区别在于工作功率,前者功率明显高于后者,推荐的工作功率为500 ~ 900范围。
问:CUT-Tag与ChIP技术如何做选择?
答:两种技术都是用于转录因子的靶基因研究,差异在于①基因组打断的方式前者为么酶切打断,后者为超声波打断,没有超声波破碎仪的可以选择前者;② CUT-Tag打断与建库同步,操作更简便;③ChIP实验中抗体结合转录因子体系较大,非特异性较低。
问:Input样本qPCR的Ct值在28以上正常吗?
答:不正常,10e7细胞的样本量,标准的实验结果Ct值在 20 ~ 24范围,如果超出范围可能得原因是①细胞数量不够;② 细胞活性低;③回收失败;需要重新实验。
问:磁珠结合抗体的步骤中,体系在垂直摇动时不流动正常吗?
答:正常,为了提高抗体磁珠结合效率,需要较小的结合体系;尽管摇动时肉眼观察不到溶液流动,但是磁珠一直在浮动的,也不会发生沉降。
填写需求描述给我们
工具快速咨询
400-8989-400
geneseed@geneseed.com.cn

 购物车
购物车





 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn