
- 首页
- >
- GENESEED
- >
人工设计circRNA以解锁新技能:基因沉默
最近,环状RNA(circRNA)在临床前和临床研究成果斐然。circRNA作为新型核酸药物,在核酸适配体、基因编辑、预防或治疗疫苗、细胞疗法、蛋白替代疗法等多个方向展现出显著的应用优势。
circRNA是否有更大的发挥空间,满足更广泛的临床需求?
circRNA可以竞争性结合miRNA,间接调控mRNA的表达。那么circRNA是否也可以直接与mRNA相互作用?
RNA-RNA相互作用会影响mRNA的稳定性,circRNA是否可以直接参与mRNA的降解,从而实现沉默基因?
最新研究
近日,韩国科学技术院Yoon Ki Kim研究团队在Molecular Cell期刊上发表研究论文:Circular RNAs trigger nonsense-mediated mRNA decay[1]。研究揭示了circRNA靶向调控无义介导的mRNA降解(NMD)机制,为circRNA在基因沉默和疾病治疗中的潜在应用开辟了广阔前景。

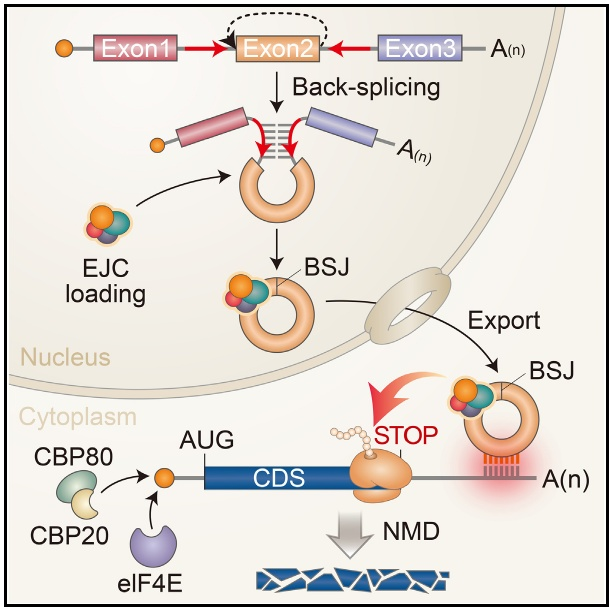
无义介导的mRNA降解(NMD)机制可以识别和下调含有过早终止密码子(PTC)的错误mRNA,通过防止产生截断和潜在有害的蛋白质,维持基因表达的保真度。NMD的执行依赖外显子连接复合体(EJC)的正确定位。
circRNA可通过与mRNA的3’UTR的相互作用,促进mRNA的快速降解,而且结合位点越多,效果越强。这种相互作用将通过circRNA上的EJC定位在mRNA的3’ UTR附近,从而导致NMD,被称为circNMD。circNMD依赖于mRNA翻译。人工设计两种circRNA变体,以靶向ATG5 mRNA 3’UTR相互作用,显著下调了ATG5 mRNA水平,并且联用效果更好。(图1)
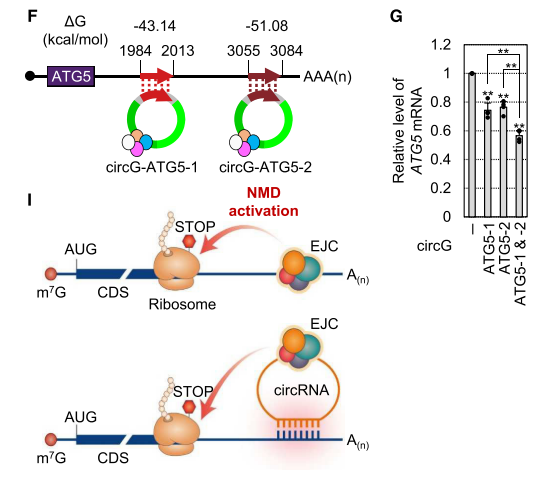
图1 人工设计的circRNA引发靶向性circNMD。
思路打开
相比同样可以进行基因沉默的miRNA,circRNA具有更高的稳定性,因而半衰期会更长,作用效果会更显著。circRNA可以通过circNMD靶向mRNA并介导其降解的发现,彰显了其在介导沉默基因表达方面的巨大潜力。
然而,要想达到有效的circNMD,仍需解决诸多问题:circRNA和mRNA的3’UTR序列碱基配对的最优规则是什么?最佳位置在哪里?在掌握了最佳靶向mRNA的规则之后,是否可以通过人工设计并体外制备circRNA来招募EJC,同时靶向mRNA,以实现circNMD?此外,如何实现circRNA的大规模制备,延长体外合成的circRNA的半衰期以及有效控制其对体内免疫的影响效果?这些问题的解决将为新型circRNA作为基因沉默治疗药物的研发提供有力的支持。
疗法开发
综上,基于circNMD原理,开发基因沉默疗法,序列设计是关键。吉赛生物可提供个性化的circRNA序列设计服务。此外,吉赛生物拥有先进的RNA环化专利技术,包括基于I型内含子自剪接法circPrecise®和T4连接酶法的circPure®,可实现精准、高效、高质量的circRNA体外环化。吉赛生物提供circRNA药物开发一站式CRO服务,为circRNA新型药物的研发提速。
参考资料
[1]https://www.cell.com/molecular-cell/fulltext/S1097-2765(24)00947-X?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS109727652400947X%3Fshowall%3Dtrue

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn