
- 首页
- >
- GENESEED
- >
吉赛生物体外合成circRNA助力创新抗肿瘤免疫疗法开发!
2024年9月,吉赛生物帮助客户完成circRNA-IL-23体外合成项目。
今年1月,客户的文章就Online啦!
2025年1月3日,南通大学医学院附属医院联合南通大学李文清教授研究团队在Materials Today Bio期刊上发表研究论文:Enhanced antitumor efffcacy of STING agonist MSA-2 by lipid nanoparticles delivering circular IL-23 mRNA and platinum-modiffed MSA-2 combination。南通大学贺甜和Yating Li为文章的共同一作。吉赛生物体外合成编码IL-23的circRNA助力该团队开发了环状IL-23 mRNA与干扰素基因刺激因子(STING)联合的有效抗肿瘤疗法。

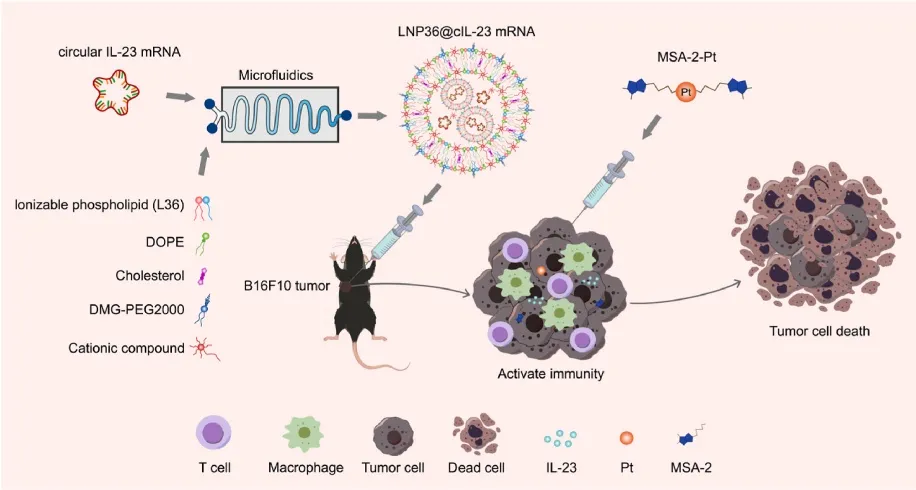
那么接下来,我们一起来剖析该研究中circRNA创新疗法的开发过程↓↓↓
靶点和药理研究
干扰素基因刺激因子(STING)作为连接先天免疫系统和适应性免疫系统的桥梁,在肿瘤免疫治疗研究领域受到特别关注。MSA-2在肿瘤微环境中增强STING激活和抗肿瘤免疫的细胞效力。研究团队此前报道了MSA-2-Pt可以通过MSA-2直接激活STING通路[1]。
IL-23是一种有效的免疫刺激因子,可以正向调节那些位于先天免疫和适应性免疫相关的细胞,在调节免疫系统的稳定性方面发挥重要作用,能够引发针对多种肿瘤的免疫抵抗,具有潜在的临床研究应用价值。
肿瘤内IL-23 mRNA治疗虽有生存周期延长报道,但整体疗效欠佳[1]。相比线性RNA,circRNA具有超高的稳定性和超长的半衰期,是新兴的药物开发研究领域。

LNP递送系统设计和合成
鉴于多尾可电离磷脂的膜不稳定性,研究合成39种新可电离磷脂(L1-L39),然后制备四组分及添加阳离子化合物的五组分LNP。五组分与四组分LNP36尺寸和zeta电位相近(图1b、c),且五组分LNP36递送GFP mRNA效率更高(图1d)。进一步发现,多种烷基链可电离磷脂具高递送效率。
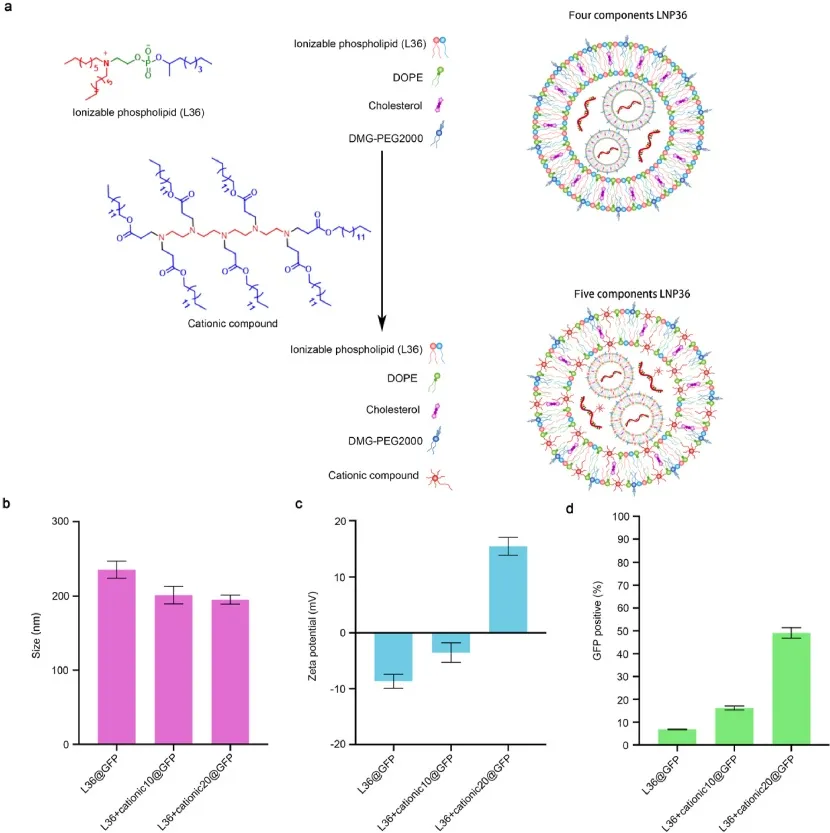
图1 四组分和添加阳离子化合物的五组分脂质纳米颗粒的制备与优化。
编码IL-23的circRNA制备
吉赛生物为研究提供了编码IL-23的circRNA的体外合成服务。吉赛生物技术团队在IL-23的CDS序列基础上,添加经过筛选和验证的介导高效翻译的IRES序列。通过模拟序列最佳环化位点,利用自主研发的基于I型内含子自剪接法自主研发的circPrecise®环化技术,在不插入外显子序列的情况下,体外合成了纯度高于90%且可以高效表达IL-23的circRNA。
LNP36递送效率验证
研究团队用LNP36包封环状IL-23 mRNA进行抗肿瘤治疗。体外B16F10细胞转染环状IL-23 mRNA验证其表达,DiI标记LNP36被B16F10细胞在3小时内快速摄取。LNP36@cIL-23转染B16F10细胞24小时后IL-23蛋白表达显著高于lipofectamine3000@cIL-23组(图2c),为后续抗肿瘤效果奠定基础。
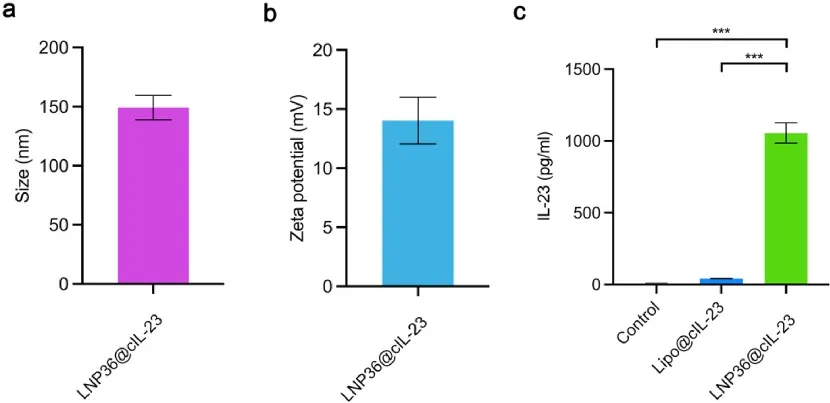
图2 LNP36在B16F10细胞中递送环状IL-23 mRNA。
疗效评估
研究通过在黑色素瘤B16F10肿瘤模型内分别单次注射LNP36@cIL-23、MSA-2-Pt和LNP36@cIL-23+MSA-2-Pt(图3a)。HE、TUNEL染色等肿瘤形态学研究表明LNP36@cIL-23 mRNA与MSA-2-Pt联合疗法可显著诱导肿瘤细胞死亡(图3c、d)。而且CD8+T细胞、CD4+T细胞和DC细胞数量均显著增加。mRNA测序结果显示,LNP36@cIL-23 mRNA + MSA-2-Pt疗法使先天免疫系统、适应性免疫系统、免疫系统细胞因子信号和IFN刺激基因明显增加。综上,LNP36@cIL-23 mRNA和MSA-2-Pt联合使用单次注射可有效诱导免疫激活。
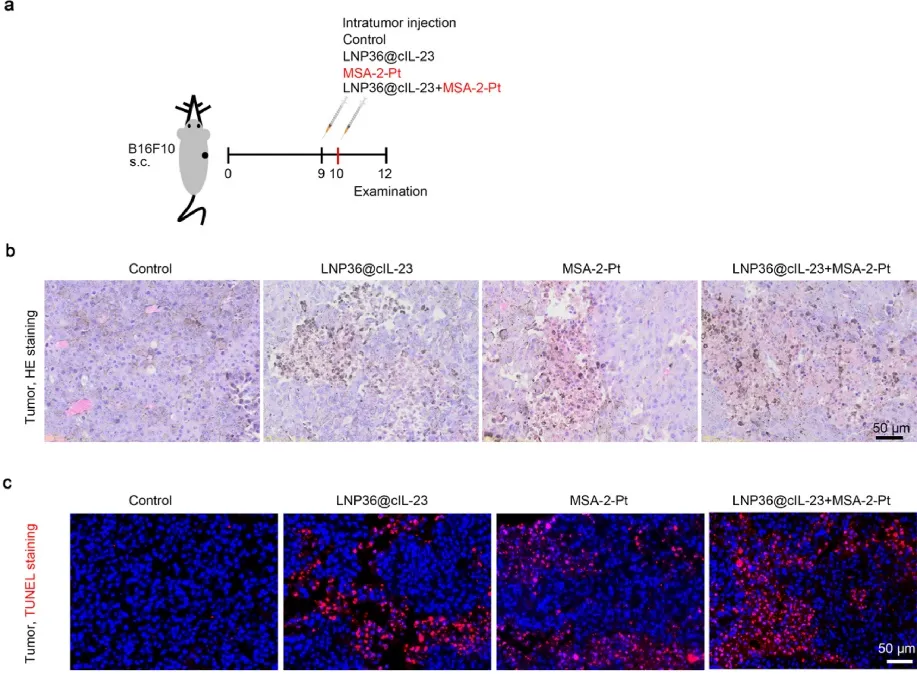
图3 联合LNP36@cIL-23 mRNA与MSA-2-Pt单次注射诱导肿瘤细胞死亡。(a)对照、LNP36@cIL-23、MSA-2-Pt和LNP36@cIL-23+MSA-2-Pt单次注射的治疗示意图。LNP36@cIL-23组给药3 μg LNP36@cIL-23 mRNA。MSA-2-Pt组给予50 μg MSA-2-Pt治疗。LNP36@cIL-23+MSA-2-Pt组注射3 μg LNP36@cIL-23 mRNA, 1 d后注射50 μg MSA-2-Pt。治疗为单次注射i.t.。
研究进一步在黑色素瘤B16F10肿瘤模型中验证了LNP36@cIL-23 mRNA与MSA-2-Pt联合使用的抗肿瘤效果。分别注射三次后,各组小鼠体重无明显变化(图4b)。LNP36@cIL-23+MSA-2-Pt组治疗后,肿瘤生长显著下降(图4c和d);且与其他组相比,LNP36@cIL-23 mRNA和MSA-2-Pt联合治疗组小鼠的存活时间延长(图4e)。结果表明,LNP递送环状IL-23 mRNA与铂修饰的MSA-2联合使用可增强抗肿瘤效果。
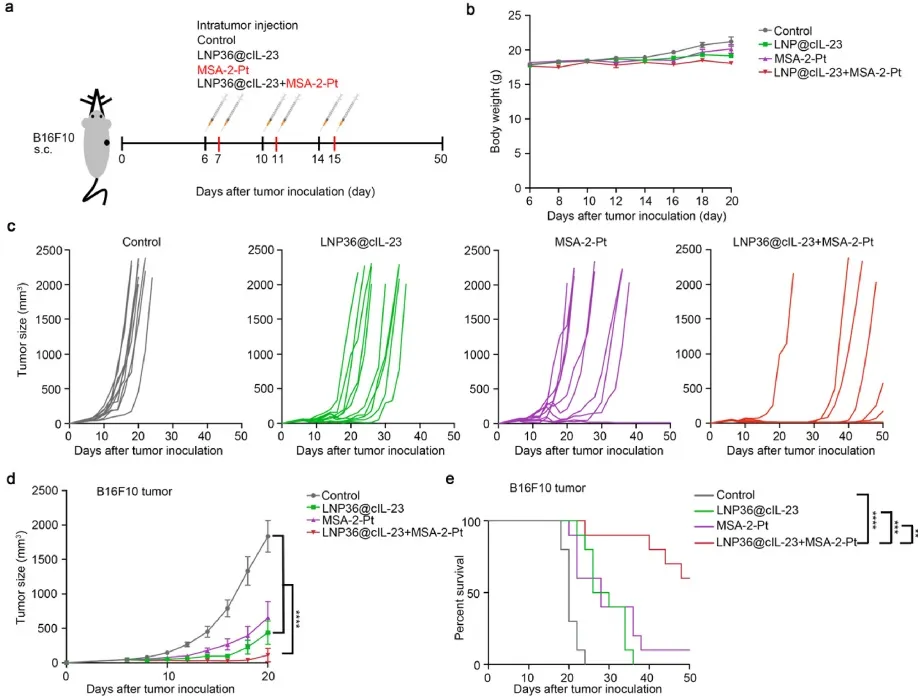
图4 LNP36@cIL-23 mRNA与MSA-2-Pt联合免疫治疗。
疗法安全性分析
研究过程中未观察到小鼠的异常行为。团队分析每组进行了肝脏、脾脏、肺和肾脏的脏器系数和病理学。结果显示,LNP36@cIL-23、MSA-2-Pt和LNP36@cIL-23+ MSA-2-Pt三组中,小鼠主要组织无明显损伤,肝脏中观察到显著的细胞凋亡,该疗法呈现出良好的生物相容性。
总结
研究合成并优化了用于递送环状IL-23mRNA的LNP36。LNP36@cIL-23 mRNA和MSA-2-Pt单次注射可诱导肿瘤免疫激活。LNP36@cIL-23 mRNA与MSA-2-Pt联合治疗显著降低黑色素瘤B16F10肿瘤生长,延长生存期,表现出良好的抗肿瘤作用,且不产生明显的毒性。利用circRNA长效表达IL-23增强STING激动剂MSA-2的抗肿瘤作用是一种创新的策略,可能成为一种有潜力的免疫治疗方法。
到此,您是否已从中获得灵感,萌生出circRNA创新疗法研发的idea?吉赛生物不仅可提供高效、高纯度、高质量的circRNA体外制备服务,还可以提供circRNA药物开发一站式CRO服务,全方位助力circRNA新型药物研发进程,加速其从实验室到临床应用的转化!
原文链接
https://www.sciencedirect.com/search?qs=Enhanced%20antitumor%20efficacy%20of%20STING%20agonist%20MSA-2%20by%20lipid%20nanoparticles%20delivering%20circular%20IL-23%20mRNA%20and%20platinum-modified%20MSA-2%20combination&pub=Materials%20Today%20Bio&cid=320038
参考资料
[1]M. Wang, Y. Cai, T. He, Y. Zhang, L. Yi, W. Li, P. Zhou, Antitumor effect of platinum-modified STING agonist MSA-2, ACS Omega 9 (2024) 2650–2656,https://doi.org/10.1021/acsomega.3c07498.

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn