
- 首页
- >
- GENESEED
- >
膀胱癌胞外囊泡中circRNA-LIPAR,促进淋巴结转移前生态位形成
膀胱癌(BCa)优先通过淋巴系统从原发部位扩散到引流淋巴结(LN)。引流LN可能不是转移细胞的被动受体,而是在转移扩散发生之前就被原发肿瘤选择性和主动地修饰。然而,BCa引流淋巴结中淋巴重塑转移前生态位形成的分子调控机制仍未明。
细胞外囊泡(EV)是大多数细胞分泌的具有脂质双分子层的纳米囊泡。含有促转移因子的肿瘤源性EV可通过循环远离其原发部位,促进转移前生态位的形成并增加肿瘤的转移。肿瘤来源的EV可通过其表面的分子“停靠”到其他组织上,然后与组织融合并释放其促转移的内容物。EV释放的促转移内含物可重塑受体细胞的基因表达和代谢模式,触发功能重编程和形态重塑,加强转移前生态位的形成。
近日,中山大学孙逸仙纪念医院陈长昊、林天歆教授研究团队在J Extracell Vesicles期刊上发表研究论文:Integrin α6-containing extracellular vesicles promote lymphatic remodelling for pre-metastatic niche formation in lymph nodes via interplay with CD151。

研究对膀胱癌(BCa)组织源性EV进行了高分辨率蛋白质组学分析,结合纳米流式细胞术,发现了一个含有整合素α6 (ITGA6+ EV)的新肿瘤源性EV亚群。BCa来源的ITGA6+ EV通过靶向淋巴内皮细胞递送circRNA-LIPAR,诱导SELE标志性的淋巴重塑转移前生态位。
机制上,LIPAR将ITGA6连接到RAB5A的开关II结构域,并维持RAB5A GTP结合的激活状态,从而通过内体运输产生装载LIPAR的ITGA6+ EV。ITGA6+ EV通过ITGA6-CD151相互作用靶向淋巴管,释放LIPAR诱导SELE过表达的淋巴重塑转移前生态位。
研究利用工程ITGA6 EV递送SELE抑制剂,用于抑制淋巴转移前生态位,从而抑制淋巴转移并延长临床前模型的生存期。
总之,该研究揭示了BCa衍生的ITGA6+ EV介导转移前生态位的机制,并提供了一种基于工程EV的对抗BCa淋巴转移策略。
让小编感兴趣的是,研究利用PIE法体外合成环状RNA LIPAR,并通过体外方式封装到工程EV中,产生富含环状RNA LIPAR的工程EV,用于验证ITGA6+ EV中LIPAR的功能和作用机制。这为外泌体中circRNA的功能和机制研究以及circRNA的递送和应用提供了新思路。
主要研究结果
一、BCa来源的EV诱导引流LN形成转移前生态位
研究分离出BCa细胞来源的EV(UM-UC-3-EV)和正常膀胱上皮细胞来源的EV(SV-HUC -1-EV)进行小鼠体内实验,证实BCa源性EV在引流淋巴结中诱导转移前生态位形成,促进BCa淋巴转移。
BCa源性EV作用LN的下一代测序(NGS)结果表明,BCa来源EV作用的LN转移前呈现淋巴管SELE过表达的生态位特征。研究还揭示了BCa衍生的EV通过促进BCa细胞在引流LN中的粘附和定植,以E-selectin(SELE)依赖的方式诱导淋巴重塑相关的转移前生态位,从而促进淋巴转移。(图1a-f)
二、促进独特生态位形成的BCa衍生EV表面有ITGA6
利用4D label-free定量蛋白组以及免疫电镜技术,研究发现位于膜双分子层外的ITGA6蛋白在BCa组织和细胞来源EV中显著高表达,BCa来源的ITGA6+ EV可在淋巴管中诱导SELE过表达,介导引流LNs转移前生态位形成。(图1g-h;图2a-g)
4D-Label free非标记定量蛋白组研究技术:无需化学标签(如同位素)标记肽段,采用DDA采集模式,利用四维(保留时间、质何比、离子强度、淌度)分离离子,检测深度更高,需求样本量更少,离子利用率更高。
吉赛生物可提供4D-Label-free、4D-DIA、Astral DIA等一系列蛋白组研究技术。
研究通过免疫共沉淀(Co-IP)、Western Blot、邻近连接技术(PLA)、多模态结构照明超分辨显微镜(Multi-SIM)等技术,证明了ITGA6在BCa衍生EV中与ITGB4形成二聚体。
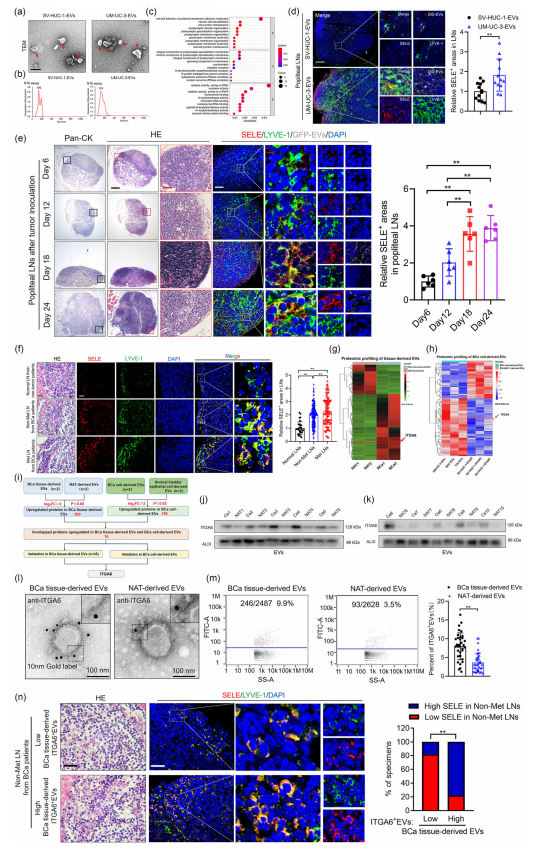
图1 BCa衍生的ITGA6+ EV与引流LN的转移前生态位相关
三、BCa衍生的ITGA6+ EV靶向HLEC上调引流LN中SELE的表达
从UM-UC-3细胞中提取DiD染料标记的EV,检测其进入腘动脉LN内不同细胞群的情况,结果发现BCa衍生的ITGA+ EV以ITGA6依赖的方式特异性靶向HLEC细胞。(图2h-m)
此外,研究利用ITGA6-Lamp2b质粒成功构建表面修饰ITGA6的工程EV,利用工程EV证明了BCa衍生的ITGA6+ EV诱导SELE过表达,通过靶向引流LNs中的HLEC,促进肿瘤细胞粘附。(图3a-q)
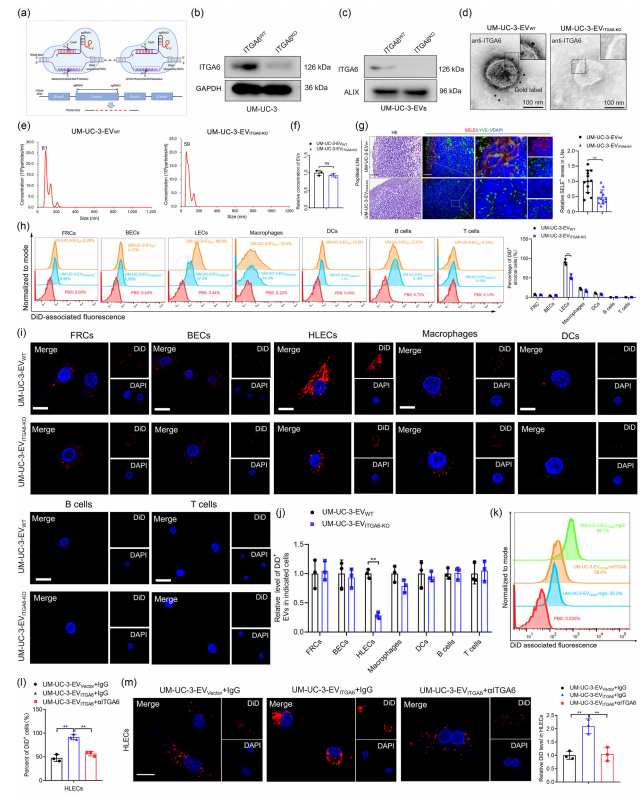
图2 BCa衍生的ITGA6+ EV在引流LN中靶向HLEC。
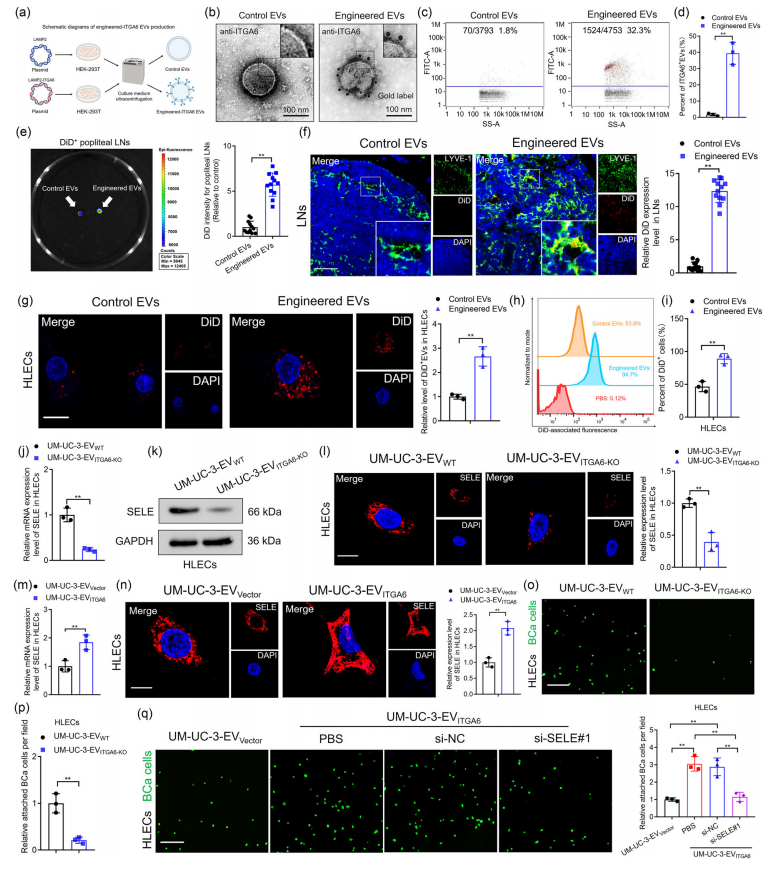
图3 BCa来源的ITGA6+ EV上调SELE表达,促进BCa细胞粘附。
四、 BCa衍生的ITGA6+ EV通过与CD151相互作用靶向HLECs
EV的高效靶向性由EV上的膜蛋白和受体细胞膜受体的特异性结合决定的,研究也利用免疫荧光、His pull-down、Co-IP等技术证明了BCa衍生的EV通过其膜上的ITGA6与CD151相互作用靶向HLEC。(图4a-i)
五、circRNA LIPAR在BCa衍生的ITGA6+ EV中富集
EV通过传递不同的生物分子,在受体细胞中更好地实现生物效应,其中在肿瘤源性EV中具有高稳定性和丰度的circRNA被广泛研究。研究对分离的ITGA6+ EV进行了circRNA-seq和相关的验证,发现在BCa衍生的ITGA6+ EV中hsa_circ_0045334显著过表达;hsa_circ_0045334的富集与引流LN中淋巴重塑相关转移前生态位呈正相关。因此,研究团队将hsa_circ_0045334命名为淋巴转移相关的转移前生态位相关circRNA(LIPAR)。(图4j-n)
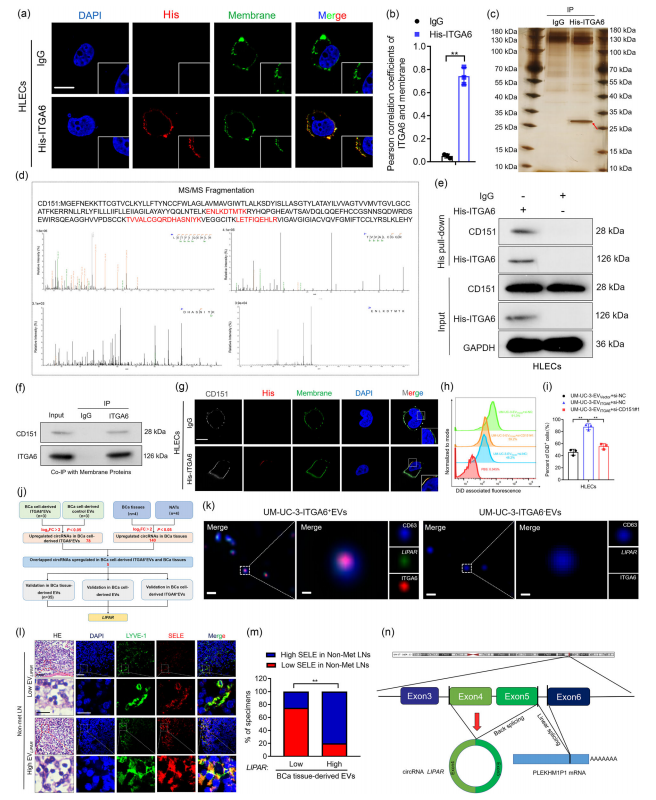
图4 ITGA6+ EV通过与CD151相互作用靶向HLECs转移circRNA LIPAR。
六、在BCa细胞中,LIPAR与RAB5A和ITGA6形成三元配合物
为探索LIPAR在BCa细胞中的被封装的机制,通过RNA pull-down结合质谱和Western Blot、RIP、Co-IP、PLA、LIPAR过表达和干扰等一系列验证,研究揭示了在BCa细胞中,RAB5A蛋白可与ITGA6和LIPAR相互作用。LIPAR作为支架连接RAB5A-ITGA6形成三元配合物的支架。(图5a-o)
七、三元复合物LIPAR/RAB5A/ITGA6激活RAB5A,将LIPAR包装成ITGA6+ EV
进一步分析LIPAR/RAB5A/ITGA6三元配合物结构,发现LIPAR在RAB5A上的预测结合区域位于开关II结构域,该结构域与蛋白质“GDP解离抑制剂”(GDI)相互作用,使RAB5A保持在非活性的GDP结合状态。LIPAR介导形成的LIPAR/ITGA6/RAB5A三元复合物可诱导RAB5A持续激活,通过内体运输过程促进LIPAR和ITGA6包装成BCa来源的EV。(图5p-v)
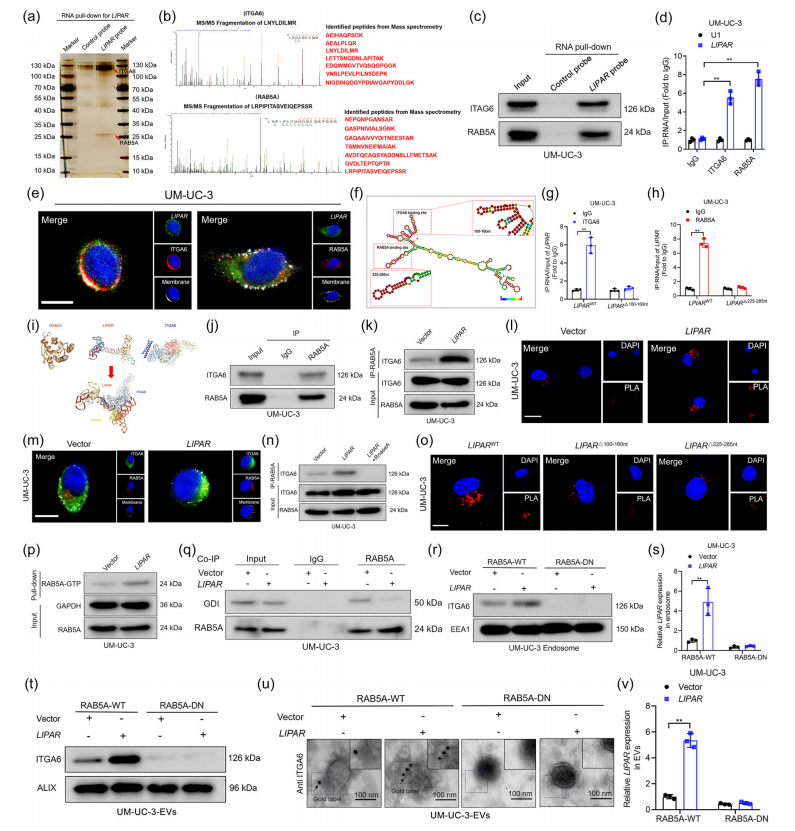
图5 LIPAR/ITGA6/RAB5A三元复合物介导LIPAR封装成ITGA6+ EV。
八、ITGA6+ EV将LIPAR传递到HLEC中以增强SELE转录
然后,研究探索了BCa衍生的ITGA6+ EV的LIPAR是否被递送到HLEC中。与LIPAR过表达的BCa来源的EV孵育后,HLEC中LIPAR的表达显著上调;而BCa细胞中LIPAR表达下调的EV则削弱了HLEC中LIPAR表达的能力。ITGA6中和抗体或敲低CD151处理HLEC的验证结果显示,LIPAR通过与ITGA6和CD151互作,被封装进ITGA6+ EV,从而精确地转移到HLEC中。(图6a-k)
研究表明,BCa衍生的ITGA6+ EV中LIPAR,介导了引流LNs中淋巴重塑相关转移前生态位的作用。LIPAR是通过怎样的机制起作用的呢?通过荧光素酶报告检测、ChIRP、ChIP等技术,研究进一步揭示了在HLEC中,BCa衍生的ITGA6+ EV中LIPAR招募转录因子p300(组蛋白乙酰转移酶),增加组蛋白3上Lys9的乙酰化水平(H3K9ac),从而激活SELE转录。(图6l-s)
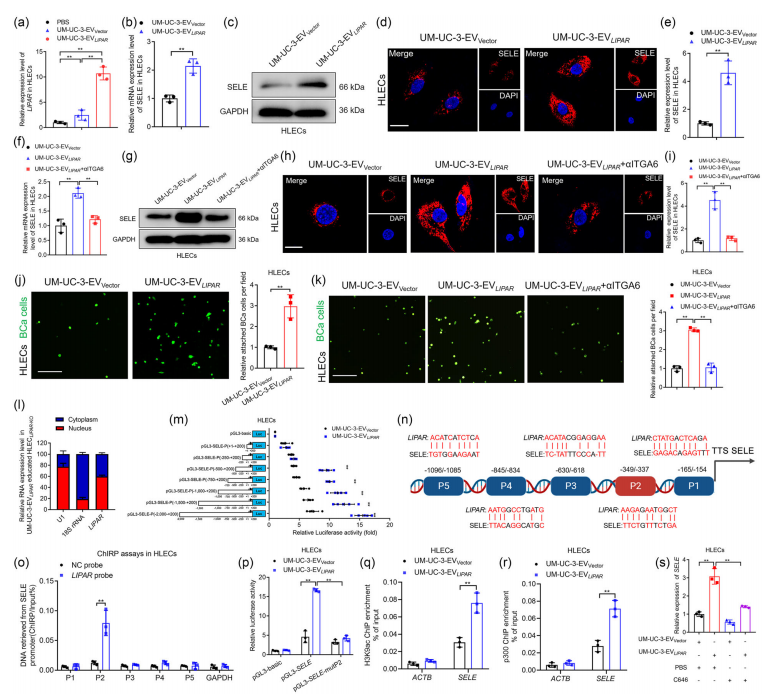
图6 ITGA6+ EV将LIPAR传递到HLEC中以增强SELE转录。
九、ITGA6+ EV包装的LIPAR诱导LN转移前生态位形成,促进小鼠BCa的转移
研究利用PIE法体外合成circRNA LIPAR,并成功将其包装进工程EV中(工程EV LIPAR),用于小鼠模型,结果表明工程EV LIPAR可成功地将LIPAR递送到引流LN,显著上调LN淋巴血管中SELE的表达,并显著诱导引流淋巴结转移前生态位,促进BCa淋巴转移。在原位BCa转移异种移植小鼠模型血管内注射的EV LIPAR显著增强BCa的盆腔淋巴结转移;而足垫注射可显著促进BCa的腘窝淋巴结转移。综上,EV LIPAR可上调SELE表达,从而创建淋巴重塑相关的转移前生态位,并促进BCa淋巴转移。(图7a-n;图8a-h)
吉赛生物拥有自主知识产权的基于T4 Rnl2酶连接、Ⅰ型内含子自剪接的两种成环技术,可提供高纯度、高环化率、高效表达、任意序列长度circRNA合成、LNP包封服务和circRNA现货产品,以及IVT circRNA相关工具酶,助力轻松体外合成circRNA,深入研究!

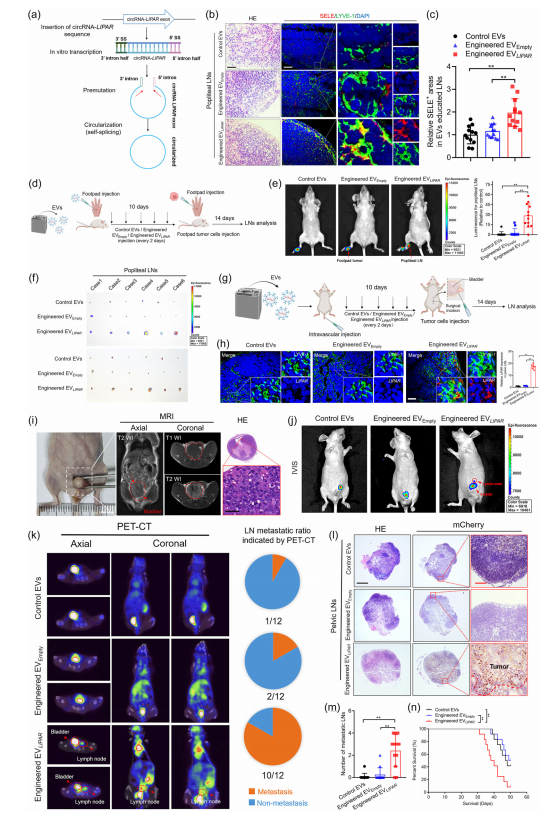
图7 ITGA6+ EV包装的LIPAR诱导转移前生态位促进LN转移。
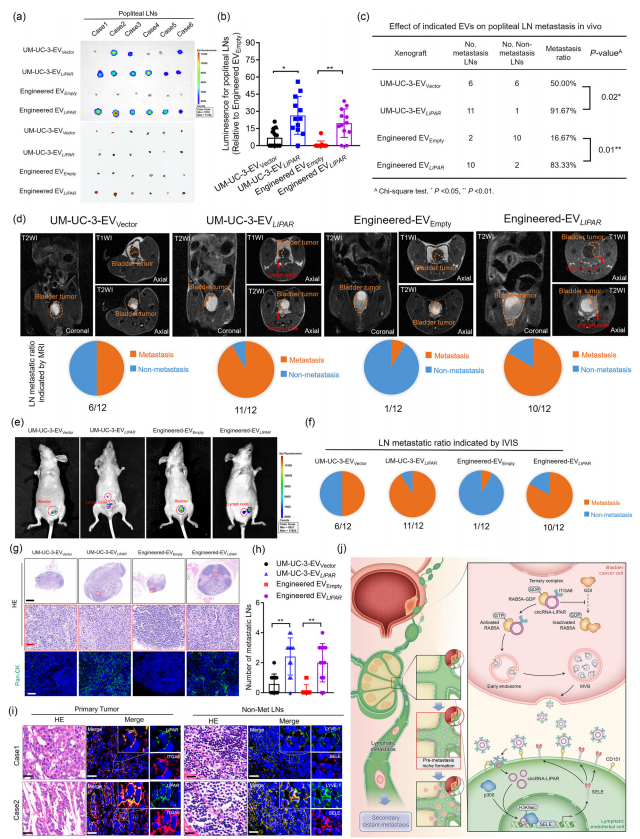
图8 LIPAR触发BCa衍生的EV诱导淋巴结转移的转移前生态位。
十、 在临床前模型中,通过工程EV靶向阻断SELE抑制转移前生态位并抑制LN转移
为了实现在引流LN中的靶向阻断SELE,研究将装载SELE选择性抑制剂的工程EV(工程EVSELE-inhibitor)注射到模型小鼠体内,以降低淋巴管中SELE的表达,结果表明,在临床前模型中,EVSELE-inhibitor可抑制转移前生态位的形成,并抑制BCa的淋巴转移。
十一、BCa中ITGA6+ EV包装的LIPAR临床相关性的多中心分析
研究还检测了ITGA6+ EV内LIPAR在BCa中的临床相关性。结果发现,在临床样本中,ITGA6/LIPAR/SELE轴广泛参与BCa转移前生态位的形成和淋巴转移。
总结
研究团队在膀胱癌组织中发现ITGA6+ EV,与引流LN 形成转移前生态位和淋巴转移呈正相关。研究还揭示了ITGA6+ EV通过向淋巴内皮细胞递送circRNA-LIPAR介导转移前生态位的机制,并开发利用工程ITGA6+ EV抑制淋巴转移前生态位,抑制BCa淋巴转移策略。
原文链接
https://isevjournals.onlinelibrary.wiley.com/doi/10.1002/jev2.12518

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn