
- 首页
- >
- GENESEED
- >
Cell Rep Med丨翻译组技术发掘肿瘤诊疗新靶点,工程化环状RNA疫苗对脑胶质瘤治疗显著
2024年10月30日,中山大学附属第一医院张弩教授团队联合吉赛生物团队在Cell子刊Cell Reports Medicine上发表了研究论文:Lnc-H19-derived protein shapes the immunosuppressive microenvironment of glioblastoma。
研究通过核糖体新生链测序(RNC-seq)及Rolysoms profiling等翻译组研究技术,突破性发现在胶质母细胞瘤(GBM)中,Lnc-H19可编码蛋白产物H19-IRP,且H19-IRP可激活CCL2和半凝集素-9的转录,增强MDSC/TAM的浸润和T细胞的衰竭,在形成免疫抑制GBM-TME中发挥关键作用。Lnc-H19可作为肿瘤相关抗原(TAA),靶向Lnc-H19制备的环状RNA疫苗circH19-vac,可触发针对GBM的强效细胞毒性T细胞反应并抑制GBM生长,为GBM免疫治疗提供了创新、强效、有前景的策略。

胶质母细胞瘤(GBM)是成人中最常见和最致命的脑肿瘤。免疫检查点阻断疗法(ICB)以增强T细胞的抗肿瘤能力是目前免疫治疗的主流。然而,GBM可增强肿瘤微环境(TME)免疫抑制,并通过DNA甲基化等表观遗传修饰促进免疫逃逸,导致免疫疗法失败。免疫治疗中最关键的挑战是如何克服高度免疫抑制的TME。因此迫切需要找到更有效的靶点来改善或逆转免疫抑制性GBM-TME。
Lnc-H19,也被称为H19,是最早被表征的lncRNA之一,多项研究表明其在包括GBM在内的各种恶性肿瘤中通过非编码功能,发挥致癌基因的作用。
癌症疫苗能靶向细胞内和细胞外抗原并刺激抗原特异性免疫反应。DNA疫苗和病毒载体疫苗整合到基因组中的风险。RNA疫苗的引入规避了这一风险并提高了安全性。与mRNA疫苗相比,环状RNA疫苗具有闭合的环状结构和较长的半衰期,具有较高的稳定性,有利于稳定表达。环状RNA疫苗已被证明可有效刺激不同疾病的免疫反应。
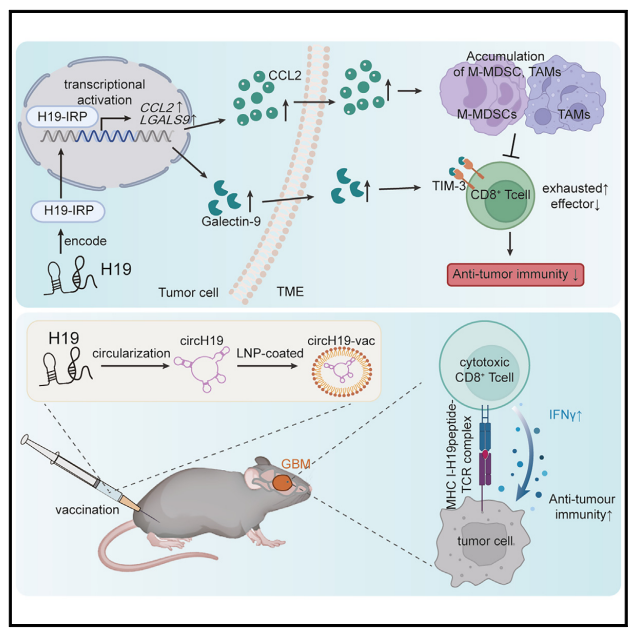
哪些lncRNA可介导免疫抑制?
研究首先利用单样本基因集富集分析(ssGSEA),从癌症基因组图谱(TCGA)和中国胶质瘤基因组图谱(CGGA)数据库中筛选在GBM肿瘤组织显著上调的H19作为研究对象。(图1A)H19表达与活化CD8+T细胞比例呈负相关,与MDSCs、巨噬细胞、调节性T细胞比例呈正相关(图1B-1E),H19高表达的GBM患者预后往往较差(图1F)。H19仅在肿瘤细胞中表达(图1G),在GBM组织中高度上调,是GBM中潜在的免疫抑制LncRNA。
H19是20世纪80年代报道的首批LncRNA之一,在不同哺乳动物物种中高度保守。以往对H19的研究主要集中在其促肿瘤功能上,如促进肿瘤生长和防止细胞凋亡,而对TME影响的研究较少。Lncrna衍生的蛋白可能与LncRNA自身的功能不同。
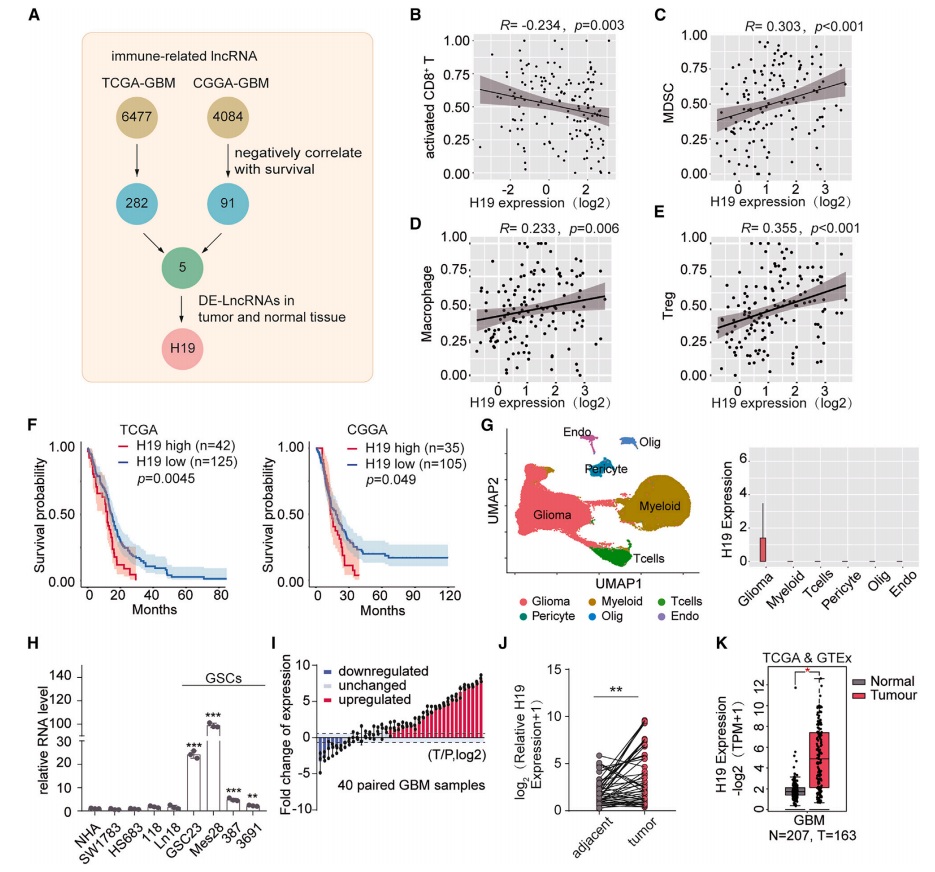
图1 H19与TME相关,在GBM中高表达。
H19是否也可能具有编码能力?
研究在揭示具有翻译潜能的LncRNA过程中应用了RNC-seq和Polysome profiling技术,并构建了一系列的载体验证具有翻译功能的ORF。
RNC-seq技术通过分离出核糖体结合RNA进行高通量测序,不经过RNase处理,保留RNA全长信息,长片段更可能跨越剪接位点,更有利于挖掘经过可变剪接的LncRNA或circRNA。
Polysome profiling技术(图2D)通过分离游离或结合不同数量核糖体的RNA,有利于验证RNA的翻译潜能和翻译水平。
研究对三种患者来源的GSC系和两种神经干细胞(NSC)系进行了核糖体新生链测序(RNC-seq),在1776个差异表达基因中,注释了339个LncRNA。H19是其中唯一与TCGAGBM患者生存负相关的潜在编码基因。研究通过多聚体图谱结果中在40-80s核糖体和多体组分都检测到H19(图2E),表明H19与核糖体结合,具有编码潜力。
H19转录本检测发现4个潜在的开放阅读框(ORF)(图2F)。为了进一步确认H19的可翻译ORF,在H19 ORF1的N端、ORF2的C端、ORF3和ORF4的C端分别插入3×FLAG标签(图2G),通过免疫印迹,结果表明只有ORF1可被翻译,ORF1被预测编码256个氨基酸的蛋白(以下称为h19免疫相关蛋白,或H19-IRP,因为它可能参与免疫抑制)。在小鼠H19中也发现了一个一致的保守的ORF,它编码一个132个氨基酸的蛋白H19-IRP。
随后,研究针对人和小鼠H19-IRP共同序列制备特异性多克隆抗体(图2I-J)。删除H19的起始密码子“ATG”,H19转染的293T细胞中H19-IRP的表达没有升高(图2K)。质谱(MS)分析鉴定了小鼠胶质瘤细胞系GL261中MES28和H19-IRP的内源性H19IRP肽(图2L)。
GBM临床样本和GL261细胞验证发现,H19-IRP优先在肿瘤组织和细胞中表达,H19-IRP表达较高与患者总生存率呈负相关(图2O-P)。
综上所述,最早发现的lncRNA之一的H19编码一种以前未被发现的蛋白质H19-IRP,与GBM患者的低生存率有关。
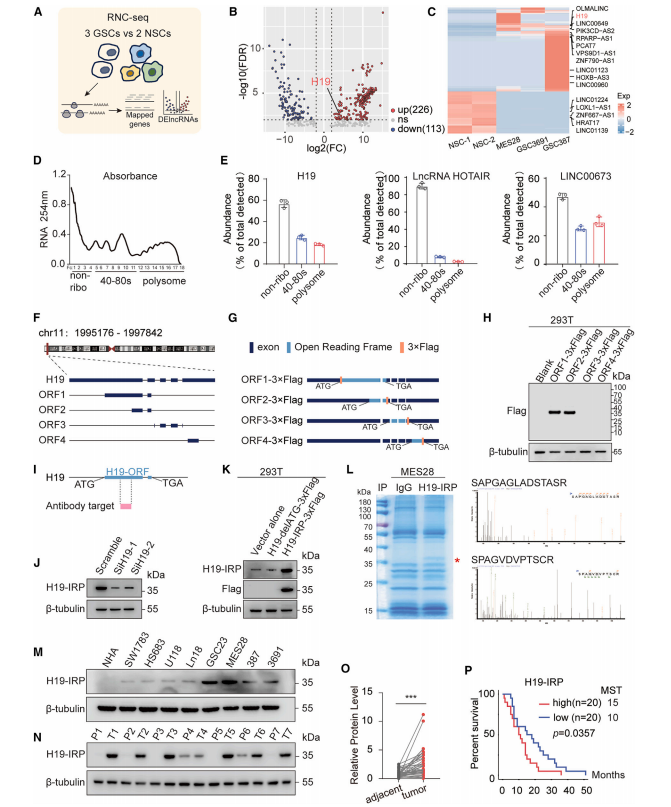
图2 H19编码256个氨基酸的蛋白质。
H19-IRP是否影响肿瘤细胞的活性?
sgRNA介导的H19-IRP敲除不影响H19的表达,但显著抑制GL261细胞中H19-IRP的表达。同样,在CT2A细胞中,通过单独诱导H19-IRP ORF过表达,只增加了H19-IRP蛋白水平。敲除和过表达H19-IRP都不会影响细胞在体外的增殖、迁移或凋亡,这表明H19-IRP与这些肿瘤特征无关。(图3)
H19与免疫抑制TME相关?
研究将H19-IRP敲除或不敲除GL261细胞原位植入C57BL/6小鼠脑内,验证了H19-IRP的缺失改变了TME,从而抑制了肿瘤的发生。(图3)
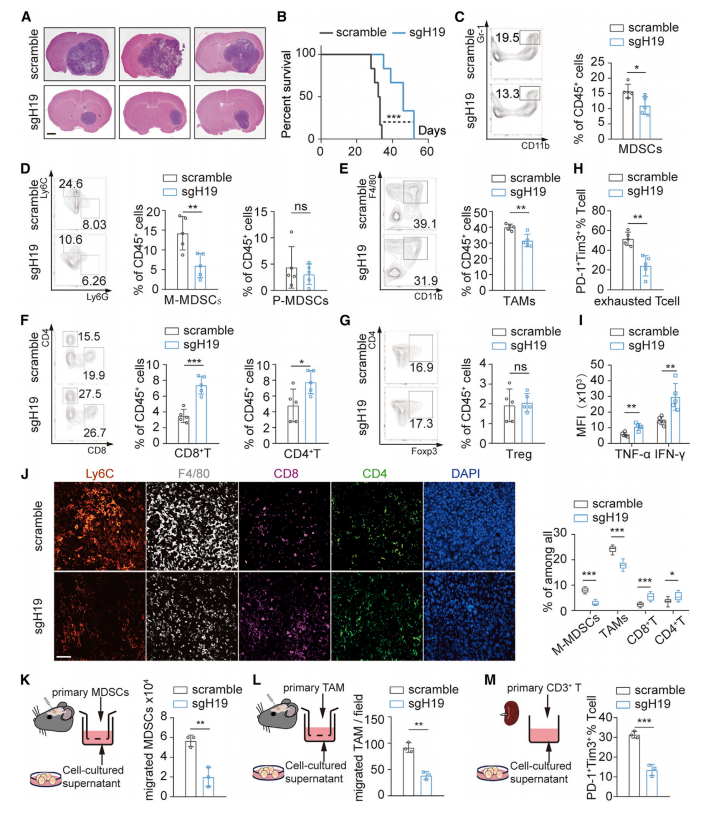
图3 H19-IRP缺乏破坏GBM进展中免疫抑制性TME的形成。
H19-IRP和H19 RNA作用一致吗?
研究通过H19敲除及分别恢复H19RNA(delATG)或H19-IRP进行体内和体外验证,发现H19-IRP通过直接塑造免疫抑制TME影响肿瘤进展,而H19 RNA通过促进肿瘤增殖和侵袭间接改变TME。(图4)
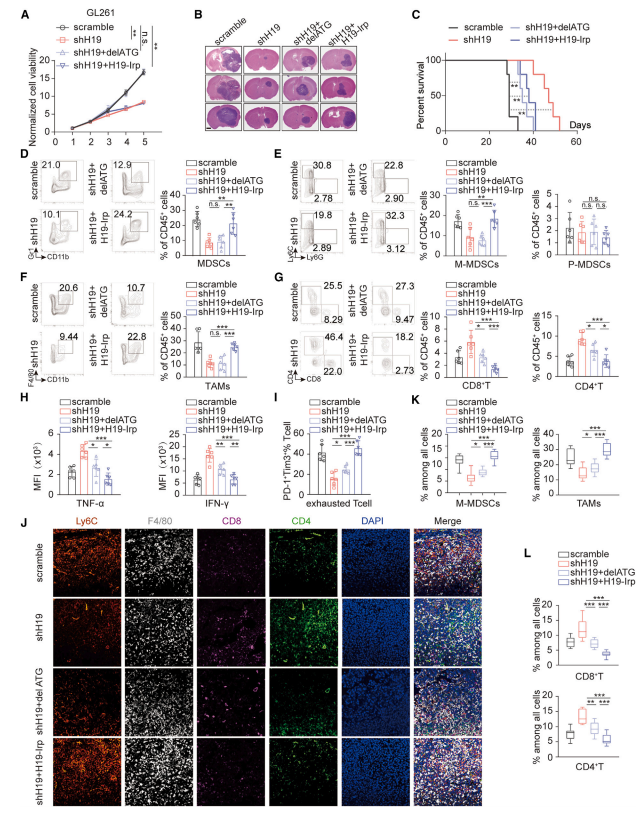
图4 H19-IRP发挥免疫抑制作用,而H19不起作用。
H19-IRP如何介导免疫抑制?
研究通过RNAseq及qPCR,发现CCL2和LGALS9(编码半乳糖凝集素-9的基因,TIM-3的配体)在GL261 sgH19细胞中显著下调(图5B、5C)。进一步利用Quantibody细胞因子抗体芯片对转染或未转染sgH19的MES28培养基进行了更全面的蛋白质组学分析、ELISA及IHC实验验证,结果表明H19-IRP可能通过增加CCL2和半乳糖凝集素-9,促进TME的免疫抑制,阻断这一过程可以显著阻碍肿瘤生长。
单独anti-PD1治疗促进T细胞杀伤和缓解T细胞衰竭,但也增加了M-MDSC的募集,可能限制疗效。研究发现,H19-IRP敲除和anti-PD1联合治疗可更进一步减少肿瘤体积,延长生存期,增强抗肿瘤作用(图5M、5N)。H19-IRP有助于GBM对免疫检查点抑制(ICB)治疗的固有抗性,H19-IRP抑制使GBM对ICB治疗敏感。
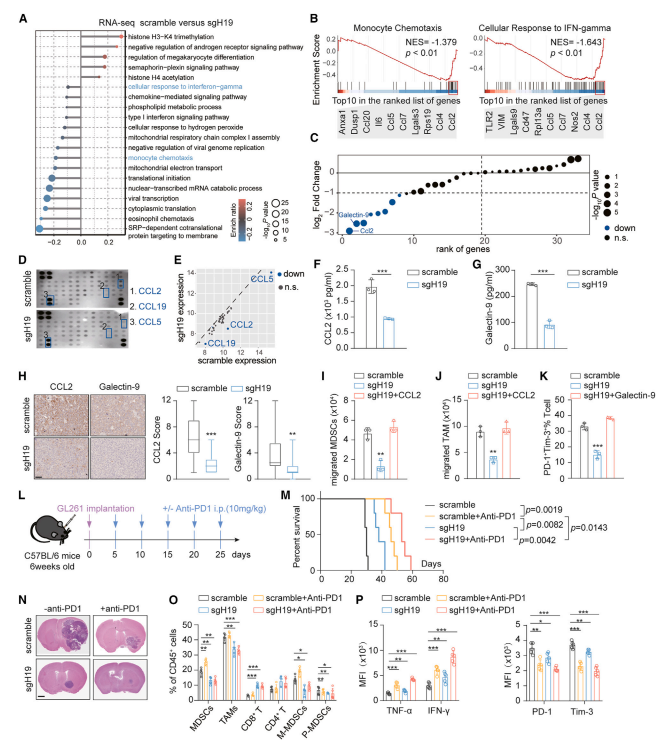
图5 H19-IRP通过靶向CCL2和半乳糖凝集素-9形成抑制性TME。
H19-IRP如何介导CCL2和LGALS9上调?
免疫荧光成像、亚细胞分离和免疫印迹结果显示,H19-IRP主要定位于细胞核(图6A和6B)。染色质免疫沉淀(ChIP)及EMSA实验证明了H19-IRP-3×FLAG特异性结合到CCL2和LGALS9启动子上,H19-IRP在驱动CCL2和LGALS9转录中起直接作用(图6E-K)。而且,homo-H19-IRP和mus-H19-IRP通过保守机制驱动CCL2和LGALS9的转录。
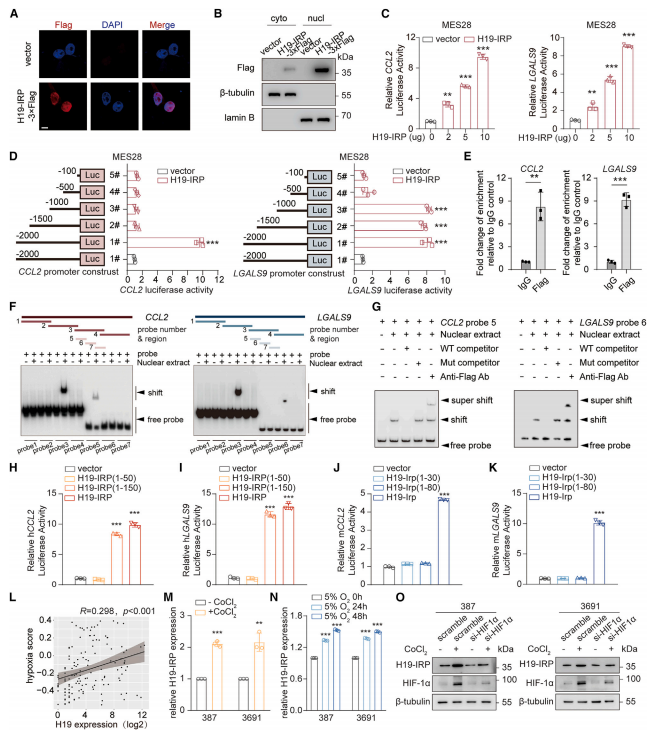
图6 H19-IRP直接激活CCL2和半乳糖凝集素-9的转录。
缺氧是否影响H19-IRP的表达?
研究进一步进行缺氧诱导,发现H19-IRP是由缺氧/HIF-1a轴驱动的,缺氧是GBM中H19-IRP表达的潜在调节剂。
H19-IRP能作为疫苗靶点吗?
H19-IRP在肿瘤细胞中的高特异性表达(图1G)强烈提示H19-IRP可作为癌症疫苗的靶点。
研究通过免疫沉淀、MS及细胞实验,发现H19-IRP的两个HLA-I结合肽(pep1:ASVGSSTV和pep2:TRRGGRGGVNEL)(图7C),且能有效激活CD8+T细胞。
相对于mRNA,环状RNA疫苗具有更高的稳定性和更长的表达时间。研究使用吉赛生物CRO一站式药物开发平台,制备含H19-ORF的circH19,并进行脂质纳米颗粒(LNP)包封,制备环状RNA疫苗(circH19-vac)。
研究通过肌肉注射给小鼠circH19-vac。与载体组相比,接受circH19-vac的组显示出更大的荧光活性。这表明circH19vac在体内和体外都能高效表达H19-IRP抗原。而接种circH19的小鼠脾T细胞在接受转染circH19的BMDC攻击后释放出大量IFN-γ。
研究对携带GL261原位肿瘤的C57BL/6小鼠进行疫苗接种,发现CircH19-vac显著降低肿瘤体积,延长生存期,重塑小鼠的TME。
为保护免疫原性肽序列,避免潜在的致瘤作用,研究选择了H19-IRP的1-188氨基酸序列,再次利用同样的策略构建了针对人的circH19(homo-circH19)(图7E),并包封LNP,制备了环状RNA疫苗(homo-circH19-vac)。homo-circH19-vac同样可显著减少肿瘤体积,延长小鼠生存时间(图7G和7H),重塑TME,使M-MDSC和TAM减少,CD8+T细胞和CD4+T细胞增加,T细胞细胞毒性增强,T细胞衰竭水平降低(图7I)。
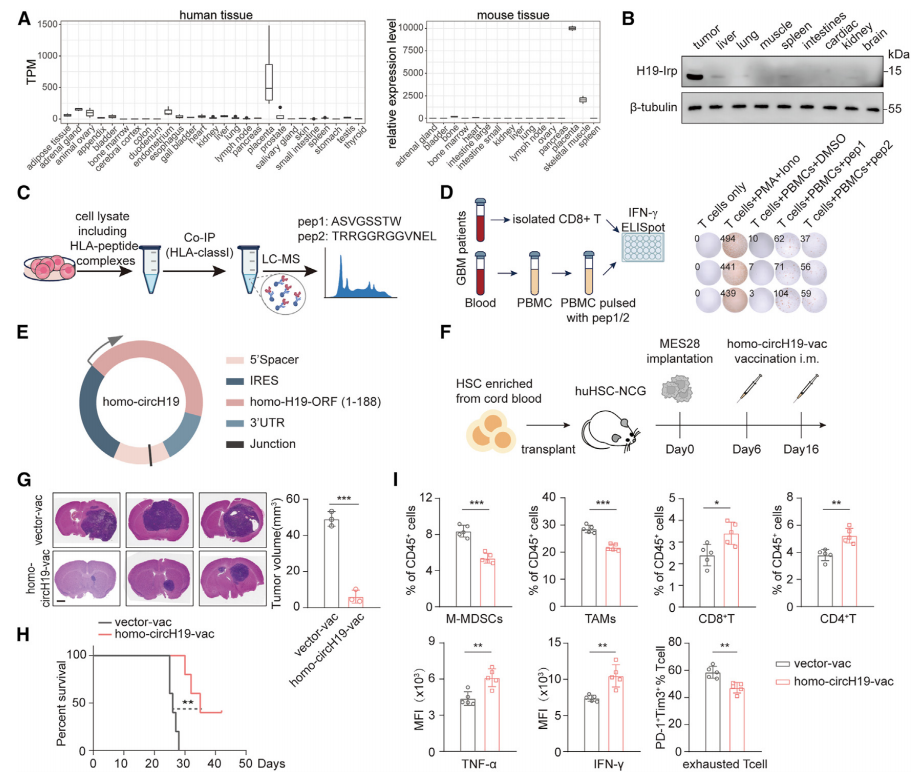
图7 H19-IRP是一种肿瘤相关抗原,具有作为疫苗靶点的潜在价值。
总结
H19是上世纪90年代被克隆发现的基因,近几十年来因其非编码功能被广泛研究。教科书上也称H19是最早发现的LncRNA,不具备翻译蛋白能力,H19进化上高度保守。研究利用RNC-seq和多聚核糖体图谱技术突破性发现H19可编码一个参与塑造GBM-TME的调节因子——H19-IRP。H19-IRP具有肿瘤表达特异性,是一种理想的癌症疫苗候选靶点。
研究开创性地将LncRNA衍生蛋白H19-IRP与环状RNA疫苗平台结合,制备了环状RNA疫苗circH19-vac,并验证了其有效激活抗肿瘤T细胞反应,而且重塑GBM-TME以提高T细胞抗肿瘤功能,展现有效的抗肿瘤功能。研究为GBM治疗提供的一种安全、有前景的基于H19-IRP和circRNA肿瘤疫苗平台的免疫治疗策略。
原文链接
https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(24)00553-6?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS2666379124005536%3Fshowall%3Dtrue

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn