
- 首页
- >
- GENESEED
- >
收藏!诺奖解读:microRNA小小身躯大大能量
北京时间2024年10月7日下午5时30分,万众瞩目的诺贝尔大会宣布,将2024年诺贝尔生理学或医学奖共同授予Victor Ambros和Gary Ruvkun,以表彰他们“发现microRNA及其在转录后基因调控中的作用”。
1993年,他们发表了意想不到的发现,描述了基因调控的一个新水平,这在整个进化过程中被证明是非常重要和保守的。

microRNA的发现
多细胞生物从单细胞祖先进化而来,每种细胞类型都获得了特定的功能,便需要越来越复杂的基因调控机制。除了由DNA结合因子作用于调控序列介导的转录基因调控外,随着生物复杂性的不断提高,其他形式的控制系统也随之出现。
几亿年来,基因编码微小的非编码RNA分子,即microRNA,在多细胞生物的基因组中扩展,对mRNA的稳定性和蛋白质翻译进行转录后控制。在Victor Ambros和Gary Ruvkun于1993年发现microRNA及其基因调控模式之前,人们对microRNA及其调控模式一无所知。
这两位诺贝尔奖获得者研究了由lin-4和lin-14基因位点改变引起发育缺陷的突变秀丽隐杆线虫。Ambros的实验室克隆了lin-4基因,并惊人地发现它不编码蛋白质,而编码一条短的22个核苷酸的非编码RNA。
同时,Ruvkun实验室确定lin-4通过其3 '非翻译区(3 ' UTR)中的多个元件调节lin-14。通过比较序列信息,他们发现短非编码lin-4 RNA与lin-14的3'UTR元件之间的部分序列互补。这提供了新概念的调控RNA类型——microRNA。
2000年,Ruvkun的实验室发现了高度保守的let-7 microRNA,随后在包括人类在内的多种动物物种中发现了同源microRNA。这激发了大量克隆和测序工作,以识别动物中的microRNA,进而发现了包含microRNA在内的一大批控制蛋白质编码基因网络的调节因子。Ambros和Ruvkun的发现揭示了一种由microRNA介导的进化保守的转录后调控机制,在动物发育和成体组织功能中起着关键作用。
_20241009134559A736.png)
图1 lin-4和lin-14 RNA中的互补序列元件[1]
microRNA的形成和作用机制
许多microRNA基因是独立的转录单位,有些聚集在一起,而有些则位于蛋白质编码基因的内含子中。典型初级microRNAs (pri-microRNA)由RNA聚合酶II转录,具有发夹结构序列。
发夹结构作为微处理器在细胞核内加工的底物,微处理器是一种含有Drosha内切酶的异源三聚体复合物,它可以切割两条链以产生前体microRNA (pre-microRNA),通常有60-70个核苷酸长,最早是在Ambros实验室检测到的。
输出蛋白5和RAN-GTP促进pre-microRNA运输到细胞质。Dicer是一种内切酶,可将pre-microRNA前体加工形成microRNA双链。
microRNA引导链被装载到含有Argonaute蛋白的沉默复合体上,而另一条客链则被移除。一旦microRNA链被装载到沉默复合体中,它就可以通过阻碍翻译和/或降解mRNA,从而对mRNA进行序列特异性的负调控。
这一调控涉及到接头蛋白TNRC6和Poly(A)结合蛋白PABPC,它们募集能降解mRNA polyA尾的脱腺苷酸酶复合物,导致mRNA降解和翻译抑制,调控机制取决于细胞环境,如发育阶段和细胞类型。
_20241009134629A737.png)
图2 人类miRISC功能模型[2]
microRNA和siRNA
microRNA加工和发挥功能的机制也可用于其他基于RNA的沉默机制,通常称为RNA干扰(RNAi),包括小干扰RNA (siRNA),内源性piwi相关RNA (piRNA)和重复相关小干扰RNA (rasiRNA)。发现双链RNA可以诱导序列依赖性基因沉默令Andrew Z. Fire和Craig C. Mello获得了2006年诺贝尔生理学或医学奖[3]。RNAi主要作为一种防御病毒感染(在植物和较低复杂性的动物中)和移除不需要的基因组元件的防御机制,但microRNA在整个发育过程和成年细胞类型中对mRNA进行转录后调控。为此,microRNA已经进化出与其靶mRNA序列的部分互补性,以“调节”各个mRNA靶标;而siRNA通常是外源的,与被切割的特定RNA靶标序列完全互补。
microRNA的生理功能
①microRNA与发育和组织功能有关:Dicer或microRNA基因缺失可能导致小鼠和斑马鱼胚胎致死,或强烈的表型变化。[4-6]
②microRNA与胚胎发育有关:最保守的microRNA基因一般在胚胎发育早期起作用,而特定在哺乳动物中进化的microRNA则一般在胚胎发育的后期阶段起作用;而物种特有的microRNA基因通常在成年细胞类型中起作用,而不是在胚胎发育中。[7]
③microRNA在成年细胞和组织中的作用:小鼠Dicer1的早期缺失会导致B细胞成熟停滞,而在神经元中的缺失会导致出生后早期死亡,伴随着小头畸形和运动协调障碍。[8-9]
④microRNA对人类发育和功能的作用:DICER1 综合征是一种罕见的遗传性疾病,由DICER1基因的突变引起,使人易于在童年时期多个器官中发展肿瘤。[10]
⑤microRNA基因突变与疾病:虽然microRNA基因的配对部分(即种子区域)很短,不太可能被偶然突变改变,但microRNA基因的种子序列中的突变与疾病有关,包括与进行性听力损失相关的miRNA-96的突变[11],与罕见眼病相关的miRNA-184的突变[12],与先天性骨骼疾病相关的miRNA-140-5p突变。[13]
⑥microRNA在诊断和治疗中的应用:目前研究者们正在开发基于微小RNA的诊断和治疗方法,用于治疗代谢紊乱、心血管疾病、神经退行性疾病和癌症等疾病。
microRNA转录后调控研究思路
①研究microRNA与生物功能、表型、疾病和健康的关系;②挖掘microRNA作为疾病的生物标记分子;③开发microRNA作为疾病的防治策略;……
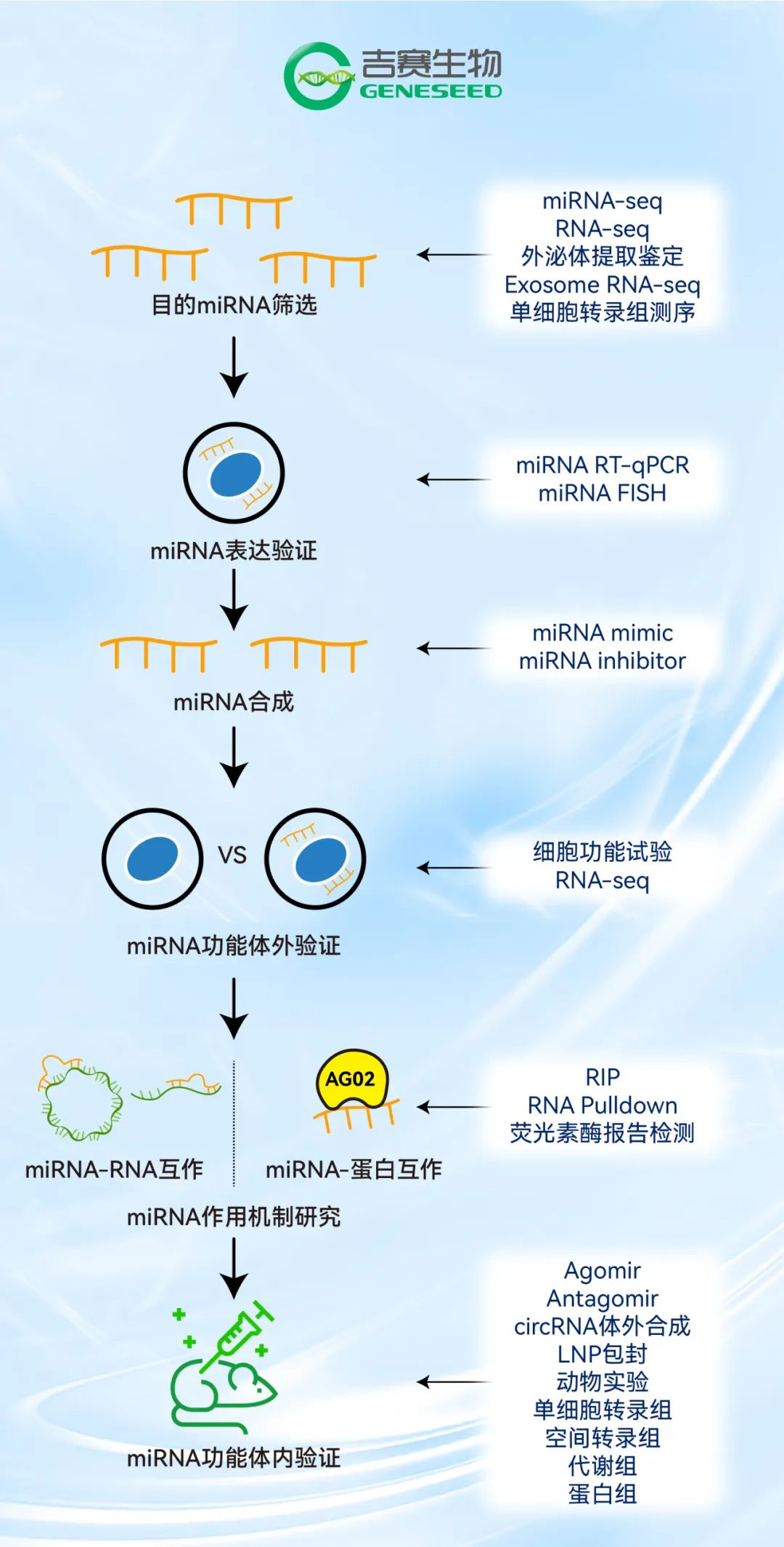
*吉赛生物提供以上完整解决方案
总结
Ambros和Ruvkun的开创性发现,以及许多基于他们发现的其它研究,揭示了基因调控的一个新维度。细胞核中的蛋白质调节RNA转录和剪接,而microRNA则调控细胞质中mRNA的翻译和降解。这一转录后基因调控机制在动物发育和成年细胞类型中具有至关重要的意义,对复杂的多细胞生命至关重要。
参考资料
[1] The Nobel Prize in Physiology or Medicine 2024. NobelPrize.org. Nobel Prize Outreach AB 2024. Tue. 8 Oct 2024.
[2] Rana TM. (2007) ‘Illuminating the silence: understanding the structure and function of small RNAs’, Nat Rev Mol Cell Biol, 8(1):23-36.
[3] Fire, A. et al. (1998) ‘Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans’, Nature, 391(6669), pp. 806–811.[4] Bernstein, E. et al. (2003) ‘Dicer is essen tial for mouse development’, Nature Genetics, 35(3), pp. 215–217.[5] Wienholds, E. et al. (2003) ‘The microRNA-producing enzyme Dicer1 is essential for zebrafish development’, Nature Genetics, 35(3), pp. 217–218.[6] Bartel, D.P. (2018) ‘Metazoan MicroRNAs’, Cell, 173(1), pp. 20–51.[7] DeVeale, B., Swindlehurst-Chan, J. and Blelloch, R. (2021) ‘The roles of microRNAs in mouse development’, Nature Reviews. Genetics, 22(5), pp. 307–323.[8] Koralov, S.B. et al. (2008) ‘Dicer ablation affects antibody diversity and cell survival in the B lymphocyte lineage’, Cell, 132(5), pp. 860–874.[9] Davis, T.H. et al. (2008) ‘Conditional Loss of Dicer Disrupts Cellular and Tissue Morphogenesis in the Cortex and Hippocampus’, The Journal of Neuroscience, 28(17), pp. 4322–4330.[10] Foulkes, W.D., Priest, J.R. and Duchaine, T.F. (2014) ‘DICER1: mutations, microRNAs and mechanisms’, Nature Reviews. Cancer, 14(10), pp. 662–672.[11] Mencía, A. et al. (2009) ‘Mutations in the seed region of human miR-96 are responsible for nonsyndromic progressive hearing loss’, Nature Genetics, 41(5), pp. 609–613.[12] Hughes, A.E. et al. (2011) ‘Mutation altering the miR-184 seed region causes familial keratoconus with cataract’, American Journal of Human Genetics, 89(5), pp. 628–633.Grigelioniene, G. et al. (2019) ‘Gain-of-function mutation of microRNA-140 in human skeletal dysplasia’, Nature Medicine, 25(4), pp. 583–590.

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn