
- 首页
- >
- GENESEED
- >
circRNA整体研究解决方案

circRNA是由前体RNA通过反向剪接(back-splicing)形成的,无5'-帽和3'-poly (A)尾结构的共价闭环单链RNA。circRNA在病理和生理过程中起重要作用,具有作为生物标记物、治疗靶点和新药物的潜力。此外,circRNA因独特的闭环结构而稳定性更强,作为线性mRNA的有效替代品,是下一代RNA疗法开发的理想平台。因此,circRNA在癌症等多种疾病中的研究备受关注。
吉赛生物是引领circRNA科学研究与应用转化的先行者,聚焦circRNA细分领域十余年,依托强大的原研开发能力,建立合成生物学、分子生物学、测序及生信等多个技术平台,可为广大科研人员提供全流程的circRNA研究解决方案。
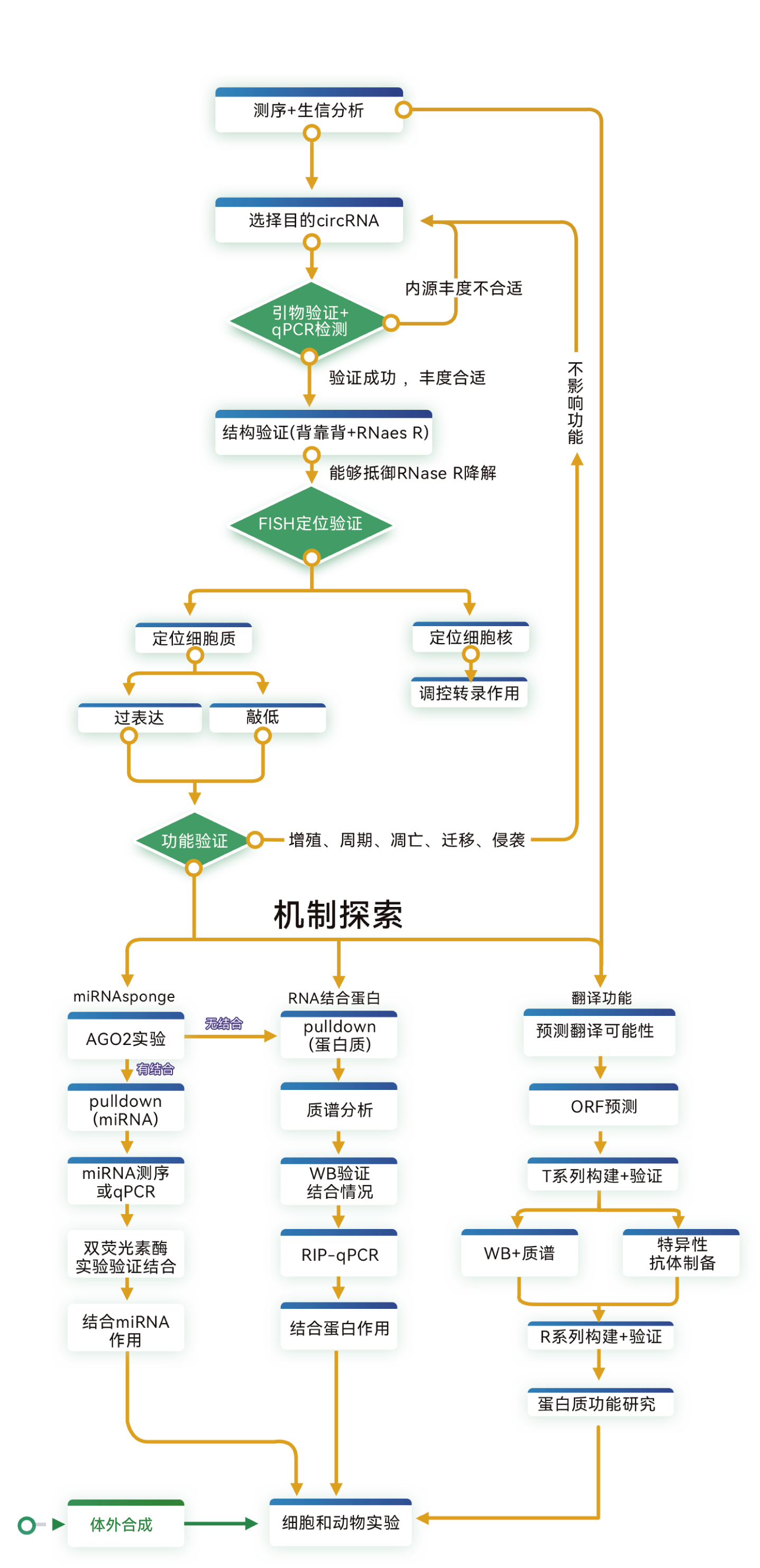

① RNA-seq或circRNA-seq(Nanopore circRNA全长测序)分析样本的转录组,筛选特定表型或疾病中表达有明显差异的circRNA;
② 转录组数据联合数据库进行生信分析,得到有潜在研究价值候选circRNA。
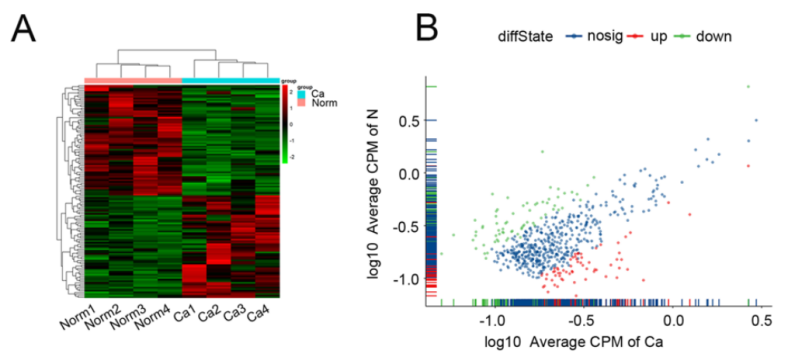
图1 circRNA-seq得到热图和散点图结果显示宫颈癌(CC)组织中存在数百个circRNA表达差异。[1]
③ 针对编码circRNA的研究,利用RNA-seq可联合翻译组测序Polysome-seq、Ribo-seq或RNC-seq等技术,通过生信分析,可挖掘潜在可翻译的RNA,并预测相应的IRES元件和ORF序列。

图2 Polysome-seq、MeRIP-seq及RIP-seq揭示 circMET是m6A修饰的潜在编码circRNA。[2]
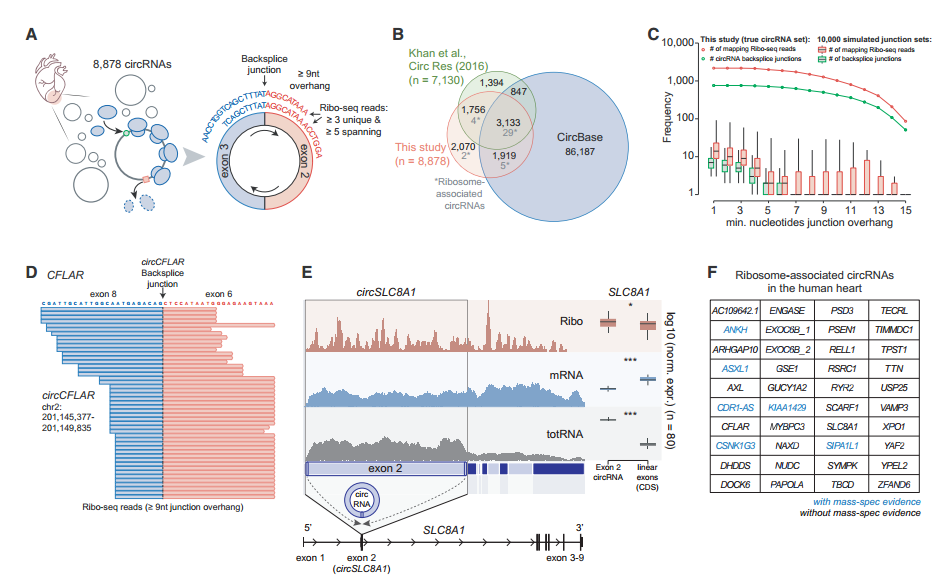
图3 Ribo-seq分析人类心脏循环的可翻译circRNA。[3]
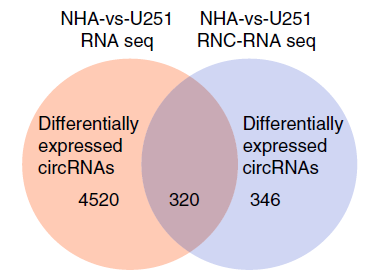
图4 RNA-seq联合RNC-seq筛选胶质瘤细胞中差异表达的可翻译circRNA。[4]
相关技术服务:
转录组测序:Nanopore circRNA全长测序、circRNA-seq、RNA-seq、Exosome RNA-seq;
翻译组测序:Polysome-seq、Ribo-seq、RNC-seq
生物信息学:生物医学大数据挖掘分析、circRNA定制化分析及绘图、常规组学及多组学联合分析、单细胞测序数据生信分析
相关产品:
提取与纯化:总RNA提取试剂(Trizol)、液体样品总RNA提取试剂(Trizol LS)、外泌体提取试剂盒
测序建库:Taqman探针法支原体检测试剂盒(UNG防污染版)、RNA-seq文库构建试剂盒、核糖体RNA去除试剂盒 (人/大鼠/小鼠)(植物)

① 内源丰度:qRT-PCR验证候选circRNA在目标样品中的内源丰度。筛选对比样品中表达量有明显差异,且内源丰度合适的circRNA进行下一步验证。
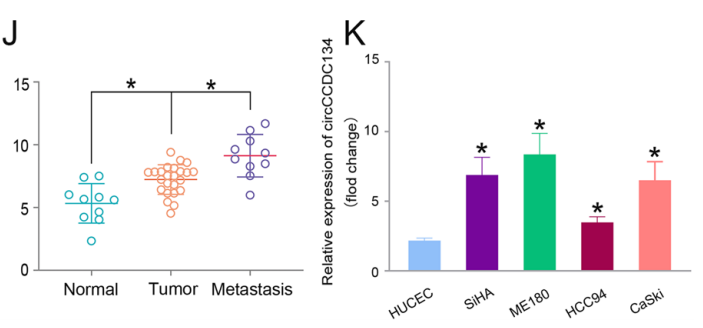
图5 qRT-PCR结果显示,circCCDC134在24个肿瘤组织和10个转移组织和CC细胞中过表达[1]
② 环状结构:设计circRNA引物进行PCR和Sanger测序,结合RNase R耐受实验鉴定候选分子的环状RNA结构。
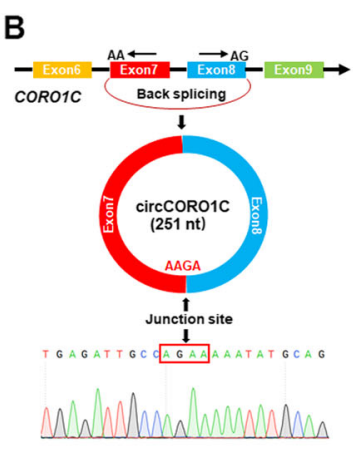
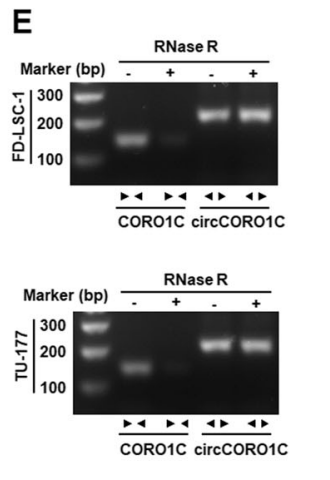
图6 鉴定circCORO1C环状结构。
B:RT-PCR和Sanger测序验证circCORO1C的反向剪接连接;
E:RNase R处理和RT-PCR分析验证FD-LSC-1和TU-177细胞中circCORO1C的稳定性。[5]
③ 作用定位:荧光原位杂交(FISH)实验分析候选circRNA主要富集于细胞核还是细胞质。
不同定位的circRNA的功能和机制类型可能不同,还会影响后续的基因敲低策略的选择。
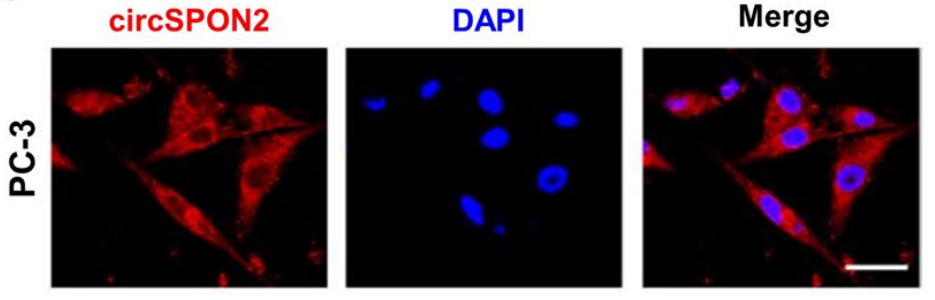
图7 用Cy3标记的circSPON2探针(红色)进行FISH检测,显示circSPON2在PC-3细胞质中富集。[6]
相关技术服务
表达量分析:引物合成及验证
结构鉴定:circRNA成环验证和全长鉴定 、RNase R耐受实验
定位分析:荧光原位杂交(FISH)、探针设计
相关产品
提取与纯化:总RNA提取试剂(Trizol)、液体样品总RNA提取试剂(Trizol LS)
表达量分析:qRT-PCR试剂盒
结构鉴定:RNase R
定位分析:原位杂交试剂盒

① 在目标细胞中过表达或敲低候选circRNA。
过表达的方式:转染体外制备的circRNA、瞬转circRNA质粒、利用腺相关病毒(AAV)感染或病毒载体构建circRNA过表达的稳转细胞株等。
敲低的方式:转染siRNA、ASO、瞬转shRNA载体、利用腺相关病毒(AAV)感染或病毒载体构建circRNA敲低的稳转细胞株等。
敲低细胞质富集的circRNA可用siRNA和shRNA,敲低细胞核富集的circRNA可用ASO。
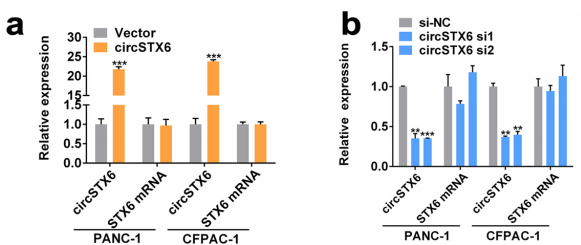
图8 qRT-PCR分析circSTX6敲低和过表达PANC-1和CFPAC-1细胞中circSTX6和线性STX6的表达。[7]
② 细胞功能实验:CCK8、流式细胞术、划痕、Transwell等实验检测细胞增殖、周期、凋亡、迁移和侵袭,体外验证circRNA的功能。
候选circRNA可影响细胞功能,则可进一步研究作用机制;对细胞功能无影响,则考虑重新筛选circRNA。
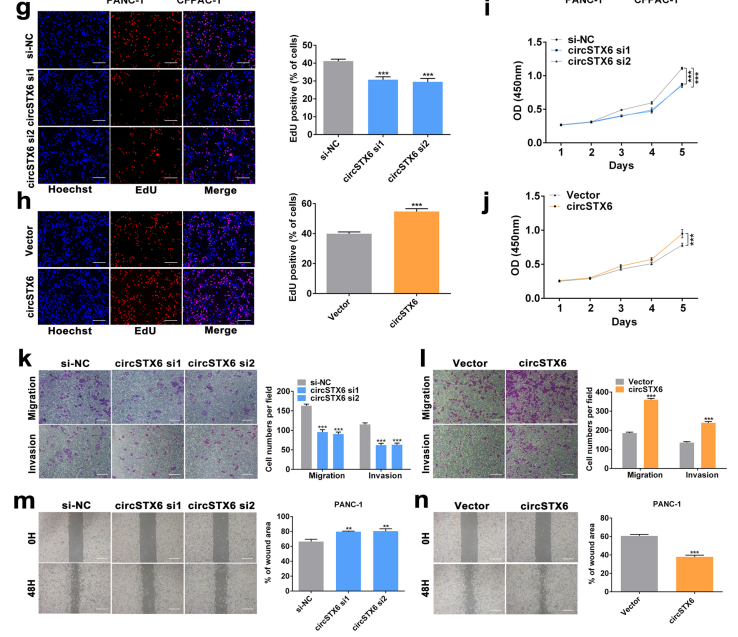
图9 通过EdU、CCK8、Transwell等细胞实验验证circSTX6的功能。[7]
相关技术服务
过表达/敲低:circRNA体外合成-LNP包封、circRNA过表达/敲低载体构建及验证、慢病毒(LV)/腺相关病毒(AAV)包装、稳株构建、siRNA/ASO设计、合成及验证
细胞功能验证:CCK8、流式细胞术、划痕、Transwell……

细胞质定位的circRNA可能通过ceRNA(competing endogenous RNAs,内源竞争RNA)、与蛋白互作、编码蛋白等机制发挥作用;而细胞核定位的circRNA可能通过与DNA或转录因子互作调控转录。
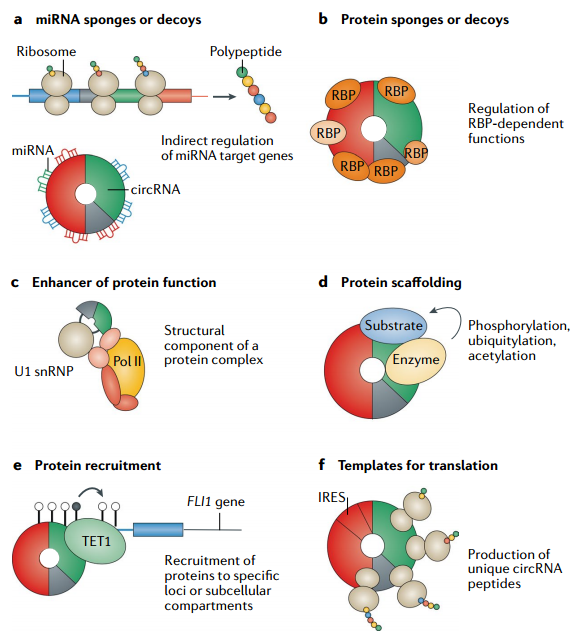
图10 circRNA功能的一般机制[8]
(1)ceRNA机制
miRNA可通过结合mRNA导致基因沉默,而部分circRNA可作为miRNA sponge竞争性结合miRNA,从而调控基因表达。
miRNA基因沉默过程中涉及的AGO2是将miRNA加工为成熟的沉默合体(miRISC)的关键蛋白。
① 验证circRNA与miRISC互作
·用anti-AGO2抗体进行RIP-qPCR实验,检测AGO2与circRNA的结合;
·通过标签法体内RNA pulldown实验,Western Blot检测pulldown产物中的AGO2,miRNA-seq分析产物中的miRNA。
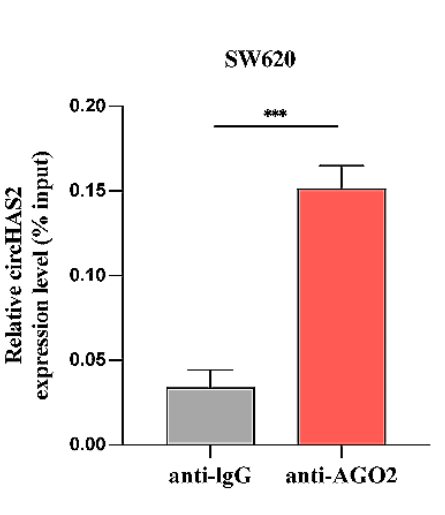
图11 采用AGO2和IgG抗体进行RIP检测SW620细胞中AGO2与circHAS2的互作。[9]
② 验证circRNA与miRNA互作
·联合miRNA-seq和circBank等数据库预测结果,筛选circRNA互作的候选miRNA;
·标签法circRNA pull-down实验可同时分析与circRNA结合的miRNA;
·FISH共定位及双荧光素酶实验验证miRNA与circRNA的结合;
·转染miRNA mimic或inhibitor到细胞中,验证miRNA的细胞功能。
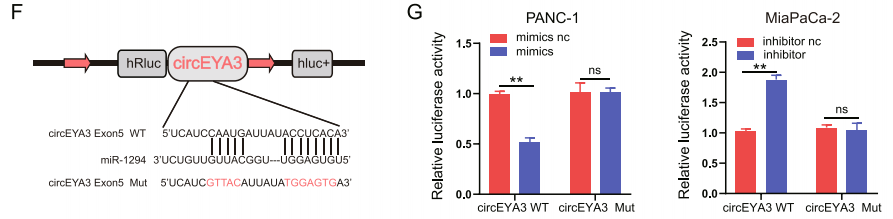
图12 双荧光素酶实验研究circEYA3与miR-1294互作。[10]
③ 研究miRNA的靶mRNA
·mRNA-seq分析联合生信分析预测结果,筛选miRNA的靶mRNA;
·转染miRNA mimic或inhibitor到细胞中,验证mRNA的表达量变化,研究miRNA与mRNA的表达关系;
·双荧光素酶实验验证miRNA和mRNA的互作。
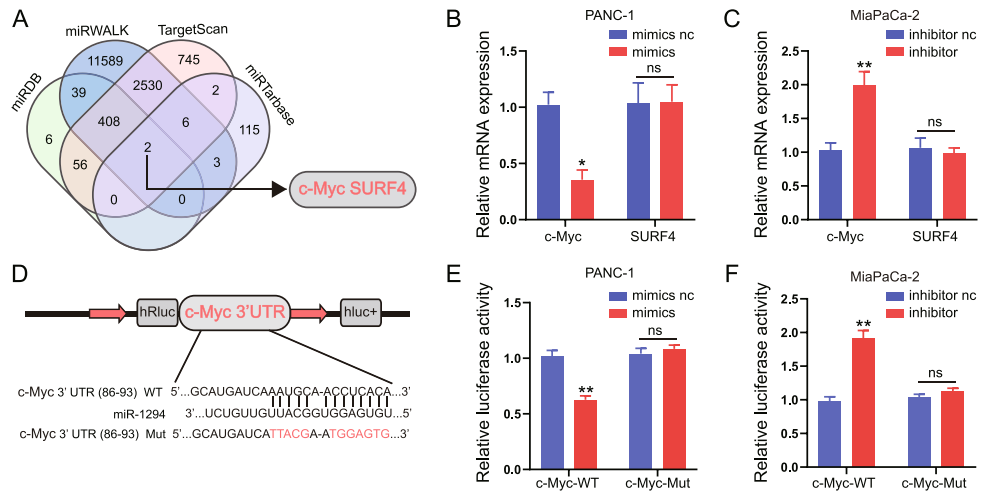
图13 A:利用数据库预测miR-1294的靶基因;
B-C:转染miR-1294 mimic或inhibitor,qRT-PCR检测c-Myc和SURF4的表达;
D-F:双荧光素酶实验验证miR-1294与c-Myc互作。[10]
④ 体外机制验证
·进行挽救实验,体外验证circRNA-miRNA-mRNA的相互作用机制。
(2)与蛋白互作影响蛋白功能
circRNA可作为支架,或蛋白sponge,调节蛋白之间的互作或蛋白的功能。
① circRNA pulldown联合LC-MS/MS和Western Blot定性或定量分析circRNA互作的蛋白。
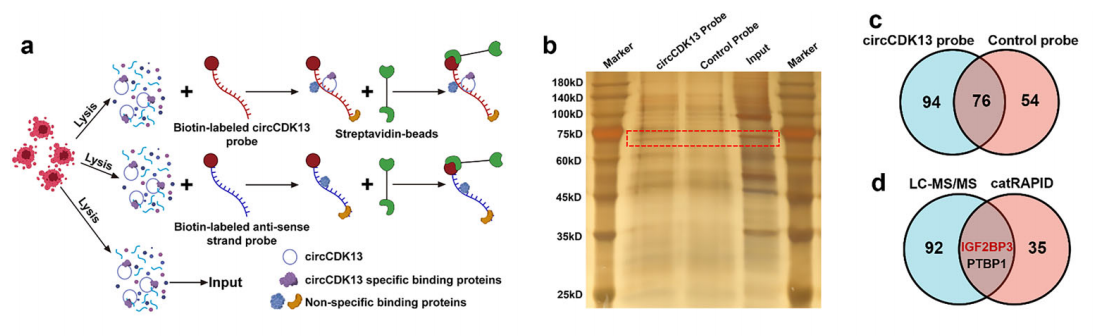
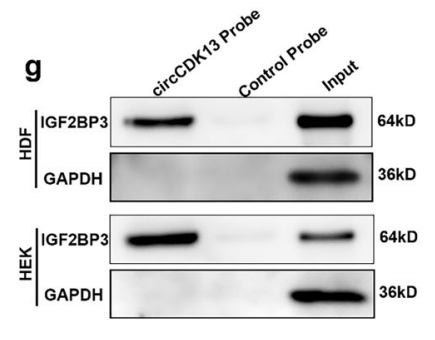
图14 探针法circRNA pulldown联合LC-MS/MS和Western Blot分析circCDK13互作的蛋白。[11]
②利用互作蛋白特异性抗体进行RIP-qPCR反向验证蛋白与circRNA的互作。
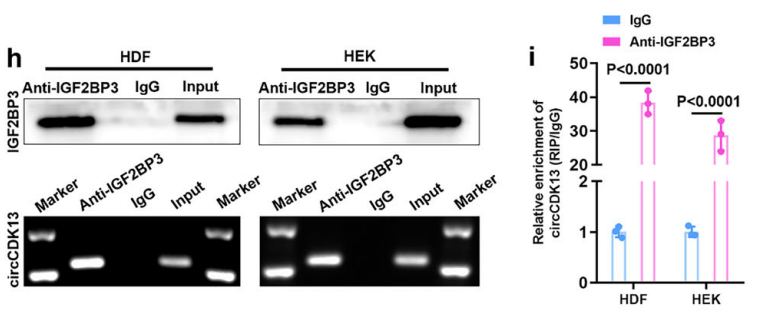
图15 RIP验证circCDK13与IGF2BP3之间的相互作用。[12]
③ 免疫荧光结合荧光原位杂交(IF-FISH)可检测circRNA和目标蛋白细胞或组织中的互作情况。
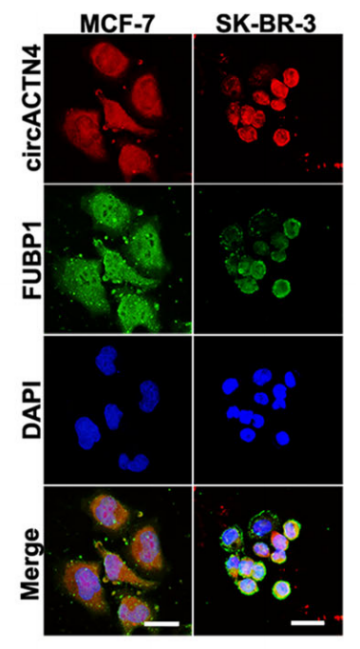
图16 IF-FISH检测显示circACTN4与FUBP1在乳腺癌细胞核中共定位。[12]
④ Co-IP实验可研究circRNA是否影响蛋白之间相互作用。
⑤ 通过细胞实验体外验证circRNA-蛋白互作机制。
(3)编码蛋白
circRNA曾被认为是“非编码RNA”,后来陆续有研究证明circRNA可以编码多肽或蛋白,并发挥特定的功能。
①编码能力
·Polysome-seq、Ribo-seq或RNC-seq联合生信分析可预测有翻译或编码可能性的circRNA及其ORF和IRES元件;
·构建T系列载体,可进一步验证circRNA的翻译能力。
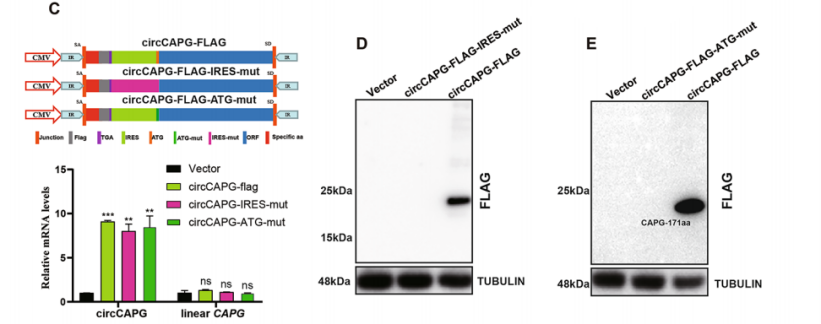
图17 构建T系列载体,验证circCAPG的编码潜能。[13]
③ 翻译产物
利用标签抗体或制备特异性抗体IP/Co-IP下拉翻译产物,采用灵敏且快速扫描的LC-MS/MS结合Western Blot分技术,定性或定量分析翻译的产物。
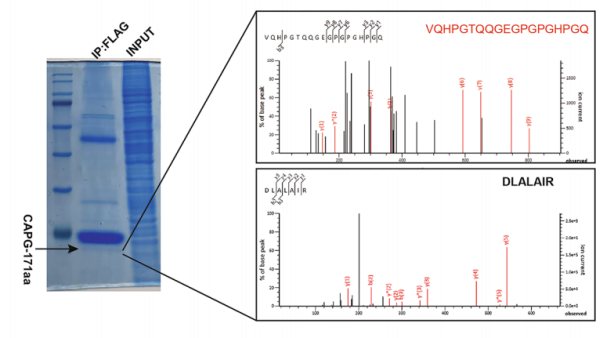
图18 利用 FLAG抗体进行IP,质谱检测circCAPG-FLAG中CAPG-171aa,并分析其氨基酸序列。[13]
③ 翻译机制
典型IRES元件介导:构建R系列载体,可验证目的circRNA翻译是否为典型IRES元件介导,并验证IRES元件的活性。
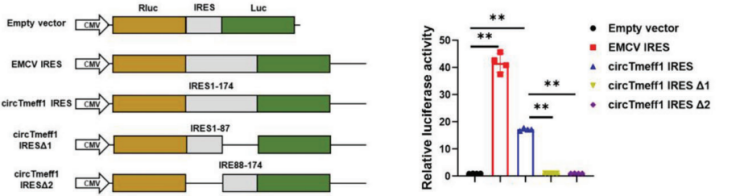
图19 构建R系列载体,验证circCAPG的IRES活性。[14]
m6A甲基化修饰介导:
·MeRIP实验可分析目的circRNA是否存在m6A甲基化修饰;
·RIP实验可分析与m6A甲基化修饰相关蛋白与目的circRNA的互作;
·通过干扰或过表达m6A甲基化修饰相关蛋白,研究m6A甲基化修饰与目的circRNA翻译的关系。
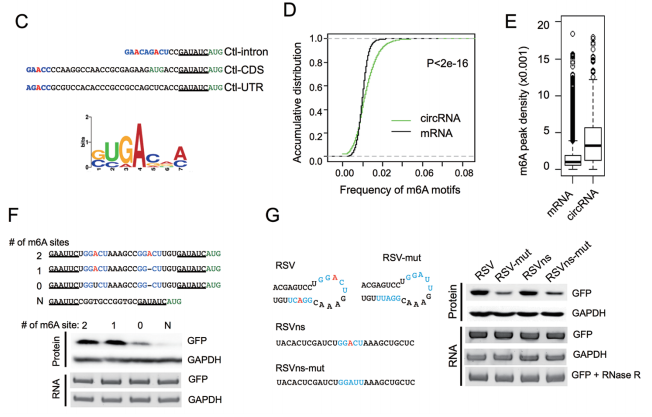
图20 根据MeRIP-seq结果研究m6A介导circRNA翻译。[15]
④ 翻译产物功能
通过构建circRNA过表达、翻译产物及相关突变体过表达载体,转染细胞进行细胞实验验证circRNA或翻译产物的功能。
(4)调控转录
① circRNA pulldown-LC-MS/MS结合RIP可分析circRNA与转录相关蛋白的相互作用;
② Co-IP实验结合circRNA的功能获得或丧失实验,可分析circRNA是否促进转录相关蛋白之间的互作;
③ 利用转录因子抗体进行ChIP-seq,结合数据库预测结果可筛选调控转录的靶基因;
④ 双荧光素酶报告检测实验结合挽救实验,可进一步验证circRNA-转录相关蛋白-靶基因DNA之间的相互调控作用。
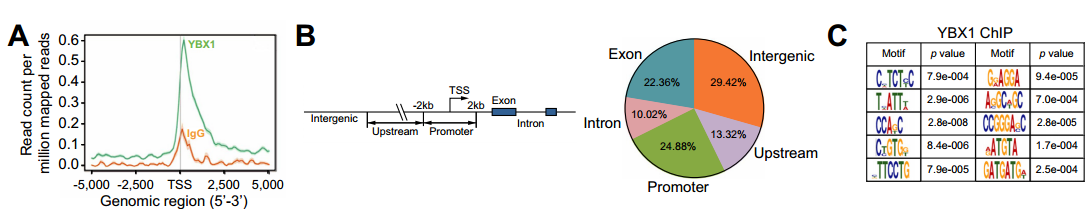
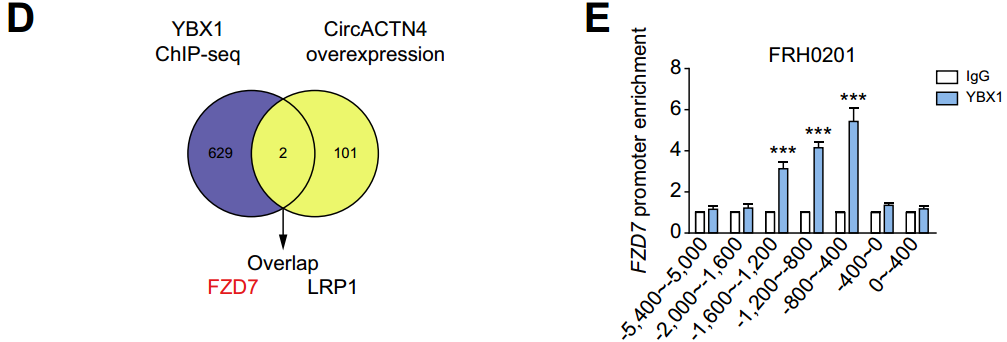
图21 CircACTN4招募YBX1共同激活FZD7转录。
A-C:利用ChIP-seq对FRH0201细胞中YBX1结合区域的全基因组分布进行分析;
D:联合RNA-seq和ChIP-seq结果得到靶基因FZD7和LRP1;
E:ChIP-qPCR检测FRH0201细胞中FZD7启动子TSS - 1200 ~ - 800 bp区域YBX1富集增加。[16]
相关技术服务
机制研究:RIP-qPCR/RIP-seq、RNA pulldown-WB/LC-MS/MS、miRNA-seq、荧光素酶报告检测、mimic/inhibitor、FISH/IF-FISH检测、Co-IP、MeRIP-seq、ChIP-seq、RNA-seq
相关产品
分子互作:RNA pull-down试剂盒、RIP试剂盒、ChIP试剂盒、Co-IP试剂盒

建立动物模型,利用体外制备的LNP-circRNA或病毒载体递送动物体内,验证circRNA在体内的功能,对生理或病理的调控作用。
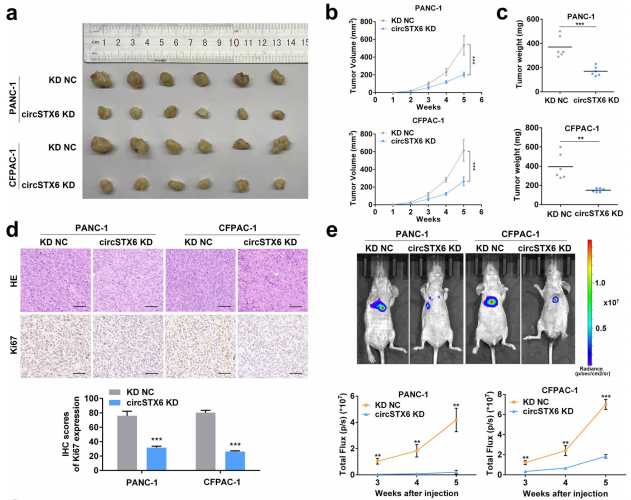
图22 动物模型验证CircSTX6在体内的作用。[7]
相关技术服务
过表达/敲低:circRNA体外合成-LNP包封、circRNA过表达/干扰载体构建及验证、慢病毒(LV)/腺相关病毒(AAV)包装、稳株构建
案例文献:
[1] Liang L et al. ALKBH5-mediated m6A modification of circCCDC134 facilitates cervical cancer metastasis by enhancing HIF1A transcription. J Exp Clin Cancer Res. 2022, 41(1):261.
[2] Zhong J, et al. Circular RNA encoded MET variant promotes glioblastoma tumorigenesis. Nat Commun. 2023, 14(1):4467.
[3] van Heesch S et al. The Translational Landscape of the Human Heart. Cell. 2019, 178(1):242-260.e29.
[4] Zhang M et al. A peptide encoded by circular form of LINC-PINT suppresses oncogenic transcriptional elongation in glioblastoma. Nat Commun. 2018 , 9(1):4475.
[5] Wu Y et al. Circular RNA circCORO1C promotes laryngeal squamous cell carcinoma progression by modulating the let-7c-5p/PBX3 axis. Mol Cancer. 2020, 19(1):99.
[6] Yao B et al. The circSPON2/miR-331-3p axis regulates PRMT5, an epigenetic regulator of CAMK2N1 transcription and prostate cancer progression. Mol Cancer. 2022, 21(1):119.
[7] Meng L et al. CircSTX6 promotes pancreatic ductal adenocarcinoma progression by sponging miR-449b-5p and interacting with CUL2. Mol Cancer. 2022, 21(1):121.
[8] Kristensen LS et al. The biogenesis, biology and characterization of circular RNAs. Nat Rev Genet. 2019, 20(11):675-691.
[9] Li H et al. CircHAS2 activates CCNE2 to promote cell proliferation and sensitizes the response of colorectal cancer to anlotinib. Mol Cancer. 2024, 23(1):59.
[10] Rong Z et al. Circular RNA CircEYA3 induces energy production to promote pancreatic ductal adenocarcinoma progression through the miR-1294/c-Myc axis. Mol Cancer. 2021, 20(1):106.
[11] Huang Q et al. circCDK13-loaded small extracellular vesicles accelerate healing in preclinical diabetic wound models. Nat Commun. 2024, 15(1):3904.
[12] Wang X et al. The circACTN4 interacts with FUBP1 to promote tumorigenesis and progression of breast cancer by regulating the expression of proto-oncogene MYC. Mol Cancer. 2021, 20(1):91.
[13] Song R, et al. A novel polypeptide CAPG-171aa encoded by circCAPG plays a critical role in triple-negative breast cancer. Mol Cancer. 2023, 22(1):104.
[14] Chen R, et al. CircTmeff1 Promotes Muscle Atrophy by Interacting with TDP-43 and Encoding A Novel TMEFF1-339aa Protein. Adv Sci (Weinh). 2023, 10(17):e2206732.
[15] Yang Y, et al. Extensive translation of circular RNAs driven by N6-methyladenosine. Cell Res. 2017, 27(5):626-641.
[16] Chen Q et al. Circular RNA ACTN4 promotes intrahepatic cholangiocarcinoma progression by recruiting YBX1 to initiate FZD7 transcription. J Hepatol. 2022, 76(1):135-147.

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn