
- 首页
- >
- GENESEED
- >
中国科学技术大学、安徽医科大学梅一德、王芳教授团队发现circDDX21可能是治疗肝细胞癌的潜在靶点
癌细胞代谢重编程是一个关键特征。与健康细胞相比,癌细胞的葡萄糖代谢存在异常改变,被称为沃伯格效应。这种效应的特点是增强了糖酵解,降低了氧化磷酸化,即使在有足够的氧气的情况下也是如此。沃伯格效应与增加的葡萄糖摄取不仅使癌细胞能够满足其高能量和生物合成需求,而且还创造了一个酸性环境,为肿瘤的生长提供了优势。然而,在快速肿瘤生长期间,葡萄糖等营养物质往往有限,这需要癌细胞重新编程其代谢以生存和增殖。现有的研究证明糖酵解在癌症的发生和发展中起着关键作用[1.2]。导致癌细胞中糖酵解增加的机制包括几种糖酵解酶表达上调和活性增强[3.4]。
磷酸甘油酸变位酶1(PGAM1)在包括乳腺癌、肺癌和肝细胞癌在内的多种人类癌症中经常上调[5]。过表达PGAM1促进癌症进展,而使用shRNA或抑制剂抑制PGAM1的表达可以有效抑制癌症进展。然而,癌细胞中PGAM1失调表达的分子机制目前仍不清楚,其次目前尚不清楚circRNA是否参与肿瘤微环境中能量应激条件下癌细胞的代谢改变。更具体地说,还没有能量代谢应答circRNA是否可以将糖酵解与肿瘤发生结合起来。
2024年5月21日,中国科学技术大学梅一德教授及安徽医科大学王芳教授团队在Cell Death & Disease发表文章Energy stress-induced circDDX21 promotes glycolysis and facilitates hepatocellular carcinogenesis。结果显示,作者发现了circDDX21在缺糖损伤中被转录因子c-Myc上调,在功能上,circDDX21通过增加PGAM1的表达来促进糖酵解。在机制上,circDDX21通过抑制MKRN3介导的PABPC1泛素化,增加PABPC1与PGAM1 mRNA的结合,从而增强PGAM1的mRNA稳定性。此外,circDDX21作为致癌的circRNA促进肝细胞癌的进展,证实了circDDX21是糖酵解的重要调节因子,并表明circDDX21可能是治疗肝细胞癌的潜在靶点。

circDDX21在缺糖损伤中被诱导及参与糖酵解途径
1. 作者通过RNA-seq分析,从缺糖损伤中的HEPG2细胞筛选得到了28个差异表达的circRNA,其中15个显著上调,并进一步筛选得到5个circRNA:circDDX21、circNEDD4L、circASPH、circCHD6和circEPB41。
2. 通过糖酵解速率测定了细胞外酸化率,发现敲低circDDX21后,HEPG2细胞的糖酵解速率急剧下降,暗示了circDDX21对糖酵解的特异性调节作用。在缺糖损伤的HEPG2及PLC细胞中circDDX21的相对表达增加。
3. 通过背靠背引物sanger/ACT-D/R酶消化/FISH/核质分离实验结果验证了circDDX21的环状结构/胞质定位及是一种在缺糖损伤诱导参与糖酵解途径的circRNA。
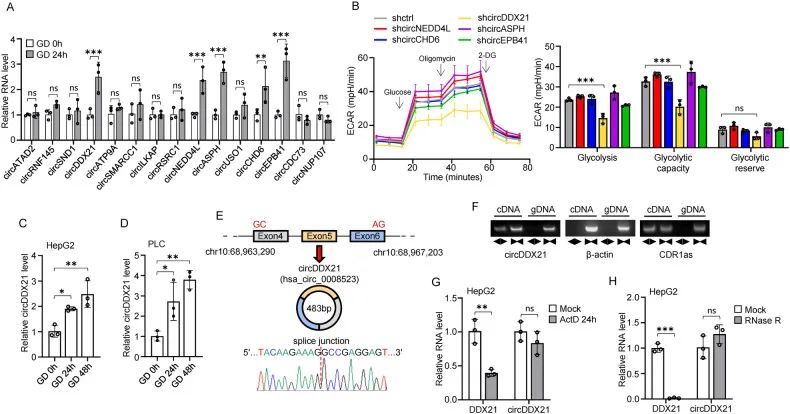
图1. 高通量测序鉴定缺糖损伤相关的circRNA
C-Myc在缺糖诱导DDX21中的作用
1. 作者发现缺糖损伤处理后的HEPG2、PLC细胞不仅诱导了circDDX21的表达,还升高了pre-DDX21 的转录水平,推测circDDX21的生成和转录有关,通过调用JASPAR数据库分析DDX21基因的启动子及内含子区域,预测到了三种转录因子的结合基序:YY1、c-Myc和NRF1,先前的报道中它们参与细胞功能及代谢调节。
2. 通过干扰实验发现,敲低c-Myc可显著降低缺糖诱导下HEPG2细胞中circDDX21的表达。
3. 为了确定c-Myc是否上调circDDX21的表达,通过CHIP/荧光素酶报告实验及JASPAR、ENCODE数据库预测发现了几个潜在的互作位点,其中BS3位点有显著富集,通过设计荧光素酶报告基因载体及敲低实验证明了c-Myc在缺糖诱导中上调circDDX21的表达。
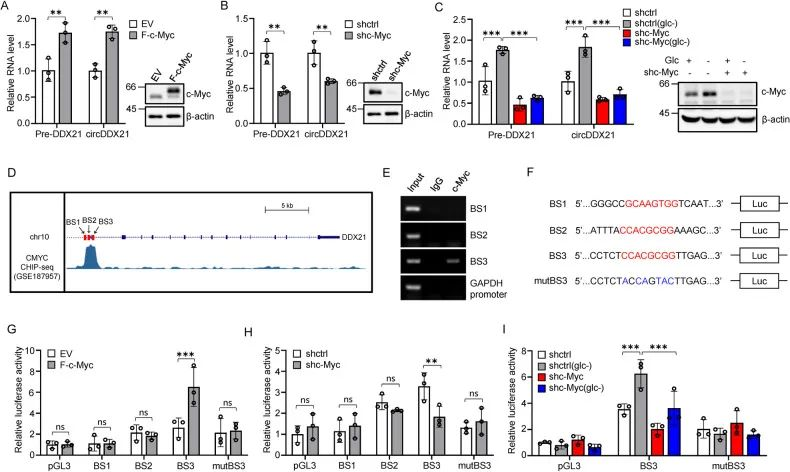
图2. c-Myc在缺糖诱导中驱动circDDX21的产生
circDDX21通过增加PGAM1表达促进糖酵解
1. 作者进一步设计敲低和过表达实验发现circDDX21可以导致HEPG2细胞的糖酵解速率降低/升高。
2. 利用碳13标记葡萄糖进行糖酵解示踪分析表明,在敲低circDDX21后,碳13标记的葡萄糖/丙酮酸、乳酸水平显著升高/降低。
3. 为了进一步探究敲低circDDX21对糖酵解的调控机制,发现特异性敲低了PGAM1的蛋白水平,而不影响其他蛋白的表达水平。
4. 同时circDDX21是否通过调节PGAM1促进糖酵解,作者设计了回补实验,在HEPG2细胞中敲低circDDX21后回补PGAM1后,糖酵解的速率升高。并在过表达circDDX21及敲低PGAM1后降低糖酵解速率。
5. 综上,circDDX21通过增加PGAM1的表达来促进糖酵解。
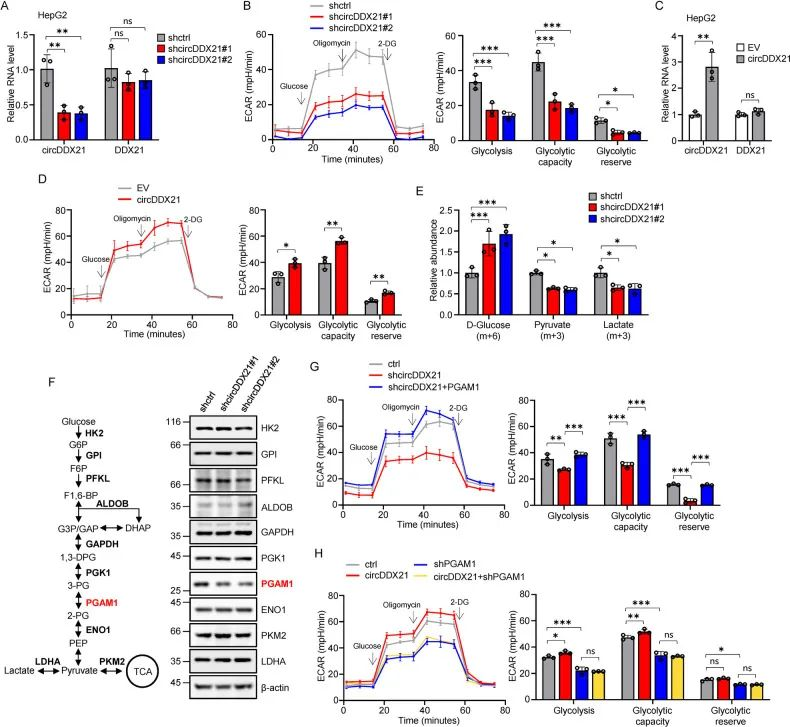
图3. circDDX21通过增加PGAM1表达促进糖酵解
circDDX21与PABPC1协同作用增加PGAM1 mRNA的稳定性
1. 作者通过敲低/过表达/FISH/核质分离/act-D实验说明circDDX21对PGAM1 mRNA具有调控稳定作用。并进一步通过RAP pulldown/质谱实验选定了3个候选蛋白ENO1、UPF1及PABPC1。发现敲低PABPC1导致PGAM1的mRNA和蛋白水平降低。
2. 通过RAP pulldown/RIP实验进一步验证了PABPC1可以与circDDX21、PGAM1结合。并利用体外合成的正义及反义circDDX21探针与纯化FLAG-PABPC1蛋白与抗FLAG M2磁珠结合,发现PABPC1可直接与circDDX21结合。
3. 作者通过敲低/过表达/回补实验证明了PABPC1可以回补由circDDX21敲低引起的PGAM1的mRNA及蛋白水平的下调。
4. 与WT circDDX21相比,mut circDDX21对PGAM1的mRNA与蛋白水平没有明显影响。
5. 同时利用RIP实验表明,敲低/过表达circDDX21会下调/上调PABPC1与PGAM1的结合。
6. 以上数据进一步表明circDDX21通过PABPC1对PGAM1的表达起到调控作用。
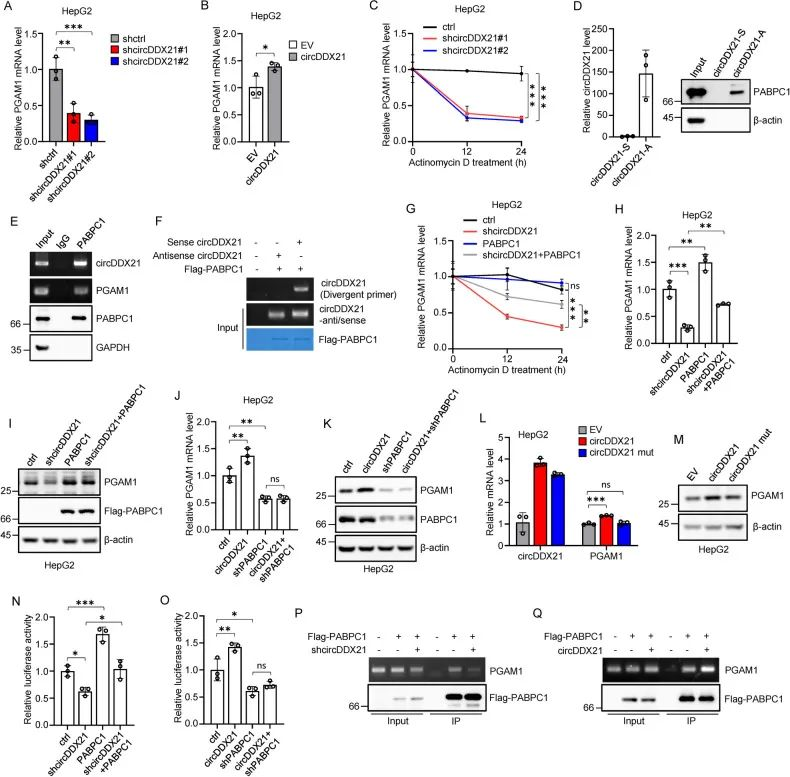
图4. circDDX21与PABPC1协同增加PGAM1的稳定性
circDDX21通过抑制MKRN3介导的PABPC1泛素化来增加PABPC1与PGAM1 mRNA 的结合
1. 先前的研究表明MKRN3介导的泛素化会减弱PABPC1与靶mRNA的结合。因此,作者推测circDDX21是否可以调节PABPC1的泛素化水平,通过体内泛素化实验,发下过表达/敲低circDDX21会下调/上调PABPC1的泛素化水平。进一步探究circDDX21对PABPC1泛素化的抑制作用是否依赖MKRN3的表达,设计了过表达/敲低circDDX21/Flag-MKRN3实验表明circDDX21抑制MKRN3来调控PABPC1的泛素化水平。
2. 进一步通过检测PGAM1的表达水平发现,circDDX21通过抑制MKRN3介导的PABPC1泛素化水平来增强PABPC1与PGAM1的结合。
3. 作者进一步探索了circDDX21如何抑制MKRN3介导的PABPC1的泛素化,通过RIP实验证明,MKRN3与PABPC1的相互作用受到circDDX21过表达/敲低的影响,并通过数据表明circDDX21与MKRN3竞争结合PABPC1的C-端区域(aa:381-636),从而破坏MKRN3-PABPC1的结合并抑制MKRN3介导的PABPC1泛素化。
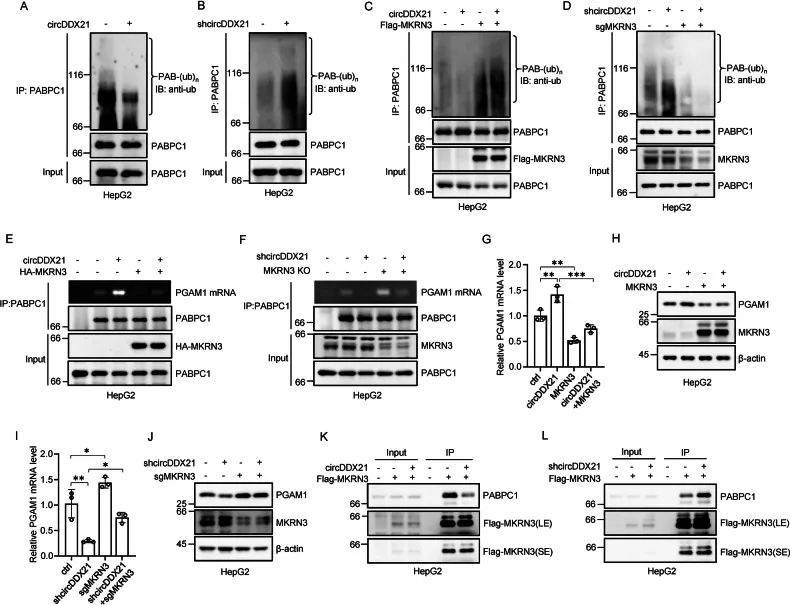
图5. circDDX21通过抑制MKRN3介导的PABPC1泛素化,增加PABPC1与PGAM1mRNA的结合
circDDX21在肝细胞癌发生中的生物学意义
1. 鉴于circDDX21在肝癌细胞中所参与的糖酵解途径,进一步验证了circDDX21对HEPG2细胞增殖的影响,circDDX21的敲低/过表达后导致HEPG2细胞增殖和克隆数量下降/升高,这些数据表明,CircDDX21通过PGAM1促进肝癌细胞的增殖。
2. 进一步通过过表达/敲低PABPC1实验表明PABPC1在介导circDDX21对细胞增殖促进发挥重要作用。
3. 以上数据暗示了circDDX21通过PCBPC1-PGAM1轴来调控细胞增殖中的潜在作用。
4. 通过小鼠的异种移植模型实验发现,敲低/过表达/回补circDDX21可以抑制/促进/恢复肿瘤的生长。以上数据表明circDDX21通过PGAM1促进体内肝癌细胞的生长,进一步验证了circDDX21在肝癌细胞中的临床意义。
5. 综上所述,这些数据有力地支持circDDX21在肝细胞癌中作为一种致癌circRNA发挥重要的作用。
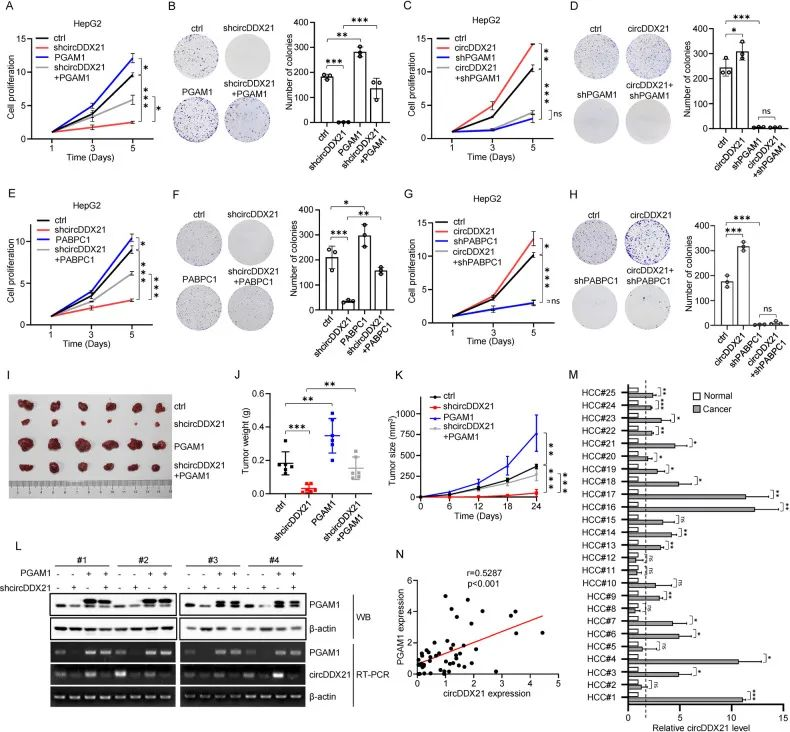
图6. circDDX21作为一种致癌circRNA促进肝细胞癌变
总结
在本研究中,作者发现确定了circDDX21是缺糖损伤诱导的circRNA。在功能上,circDDX21通过增加PGAM1表达促进糖酵解。机制上,circDDX21通过抑制MKRN3介导的PABPC1泛素化,增加PABPC1与PGAM1 mRNA的结合,从而增强PGAM1 mRNA的稳定性。此外,circDDX21作为一种致癌circRNA,可促进肝细胞癌的进展。综上所述,这些发现提示缺糖损伤诱导的circDDX21在糖酵解调控中发挥重要作用,并揭示了circDDX21在促进肝细胞癌变中的关键作用。
原文链接
https://pubmed.ncbi.nlm.nih.gov/38773094/
参考文献
[1] Gatenby RA, Gillies RJ. Why do cancers have high aerobic glycolysis? Nat Rev Cancer. 2004 Nov;4(11):891-9. doi: 10.1038/nrc1478. PMID: 15516961.
[2] Abdel-Wahab AF, Mahmoud W, Al-Harizy RM. Targeting glucose metabolism to suppress cancer progression: prospective of anti-glycolytic cancer therapy. Pharmacol Res. 2019 Dec;150:104511. doi: 10.1016/j.phrs.2019.104511. Epub 2019 Oct 31. PMID: 31678210.
[3] Nowak N, Kulma A, Gutowicz J. Up-regulation of Key Glycolysis Proteins in Cancer Development. Open Life Sci. 2018 Dec 31;13:569-581. doi: 10.1515/biol-2018-0068. PMID: 33817128; PMCID: PMC7874691.
[4] Cantor JR, Sabatini DM. Cancer cell metabolism: one hallmark, many faces. Cancer Discov. 2012 Oct;2(10):881-98. doi: 10.1158/2159-8290.CD-12-0345. Epub 2012 Sep 25. PMID: 23009760; PMCID: PMC3491070.
[5] Fothergill-Gilmore LA, Watson HC. The phosphoglycerate mutases. Adv Enzymol Relat Areas Mol Biol. 1989;62:227-313. doi: 10.1002/9780470123089.ch6. PMID:2543188.

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn