- ·
慢病毒(LV)包装
- 产品介绍
- 案例解析
- 结果展示
- FAQ
服务介绍
慢病毒可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达,可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的基因治疗效果,具有广阔的应用前景。
吉赛生物针对各种RNA提供慢病毒包装服务,包括circRNA、mRNA和lncRNA。
技术优势
1. 用于常规细胞感染,强大的基因传递工具;
2. 永久整合到基因组中,便于稳转株的构建,持续传代;
3. 可用于转基因动物和动物模型的构建;
4. 基因治疗:通过造血干细胞治疗遗传性疾病。例如白血病,地中海贫血等;
5. 细胞治疗:CAR-T治疗癌症。
客户提供
由我司构建载体:载体构建的合同编号和基因名称(ID)。
由客户提供载体:载体序列文件,或酶切位点位置以及5’LTR-3’LTR之间的序列长度;浓度>500ng/ul、质粒量>10ug的质粒
我们提供
1. 目的基因慢病毒和对照慢病毒;
2. 慢病毒滴度检测报告。
慢病毒载体的研究发展得很快,研究的也非常深入。该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达。在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果,因此具有广阔的应用前景。
案例1:

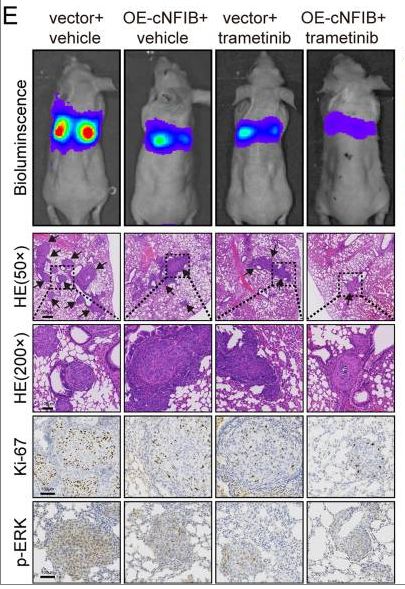
本文研究中,作者通过环状RNAs测序,在人类ICC组织中鉴定出circNFIB (hsa_circ_0086376,以下简称cNFIB)。并进行了一系列的体外和体内实验,探讨cNFIB对MEK抑制剂曲美替尼抗肿瘤活性的影响。
研究结果表明,与曲美替尼和编码cNFIB的慢病毒载体共治疗比单独的曲美替尼治疗表现出更大的抑制作用。[1]
案例2:

Neuro-oncology杂志(IF=10.247)在线发表了中山大学附属第一医院张弩教授最新的研究成果,报道发现EGFR来源的circRNA可以特殊的滚环翻译和程序化-1核糖体移码(-1PRF)诱导的框外终止密码子(OSC),形成一系列的滚动翻译EGFR(rtEGFR)。rtEGFR可以结合并稳定EGFR,在成人胶质母细胞瘤(GBM)成瘤和Nimotuzumab药敏相关。
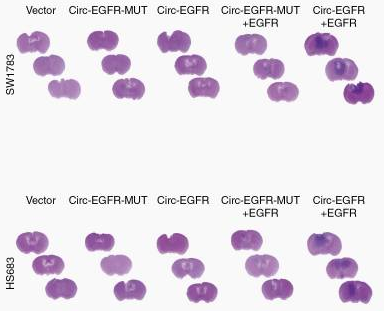
在本文研究中,研究者使用慢病毒转染的稳定细胞系用于评估rtEGF蛋白在体外和体内的生物学功能。研究结果显示circEGFR在GBM标本中高表达,circEGFR翻译生成的rtEGFR具有促进BTIC细胞成瘤的能力,干扰circEGFR后抑制成瘤速度。[2]
参考文献:
[1] Jinpeng Du,Tian Lan,Haotian Liao , et al.CircNFIB inhibits tumor growth and metastasis through suppressing MEK1/ERK signaling in intrahepatic cholangiocarcinoma Mol Cancer.(2022).10.1186/s12943-021-01482-9.
[2] Y. Liu, Z. Li, M. Zhang, H. Zhou, X. Wu, J. Zhong, F. Xiao, N. Huang, X. Yang, R. Zeng, L. Yang, Z. Xia, N. Zhang, Rolling-translated EGFR Variants Sustain EGFR Signaling and Promote Glioblastoma Tumorigenicity,Neuro Oncol(2020). 10.1093/neuonc/noaa279.
慢病毒感染293T 细胞荧光图
视野
明场图
荧光图
视野1

视野2

感染48h的细胞图
qPCR检测病毒滴度
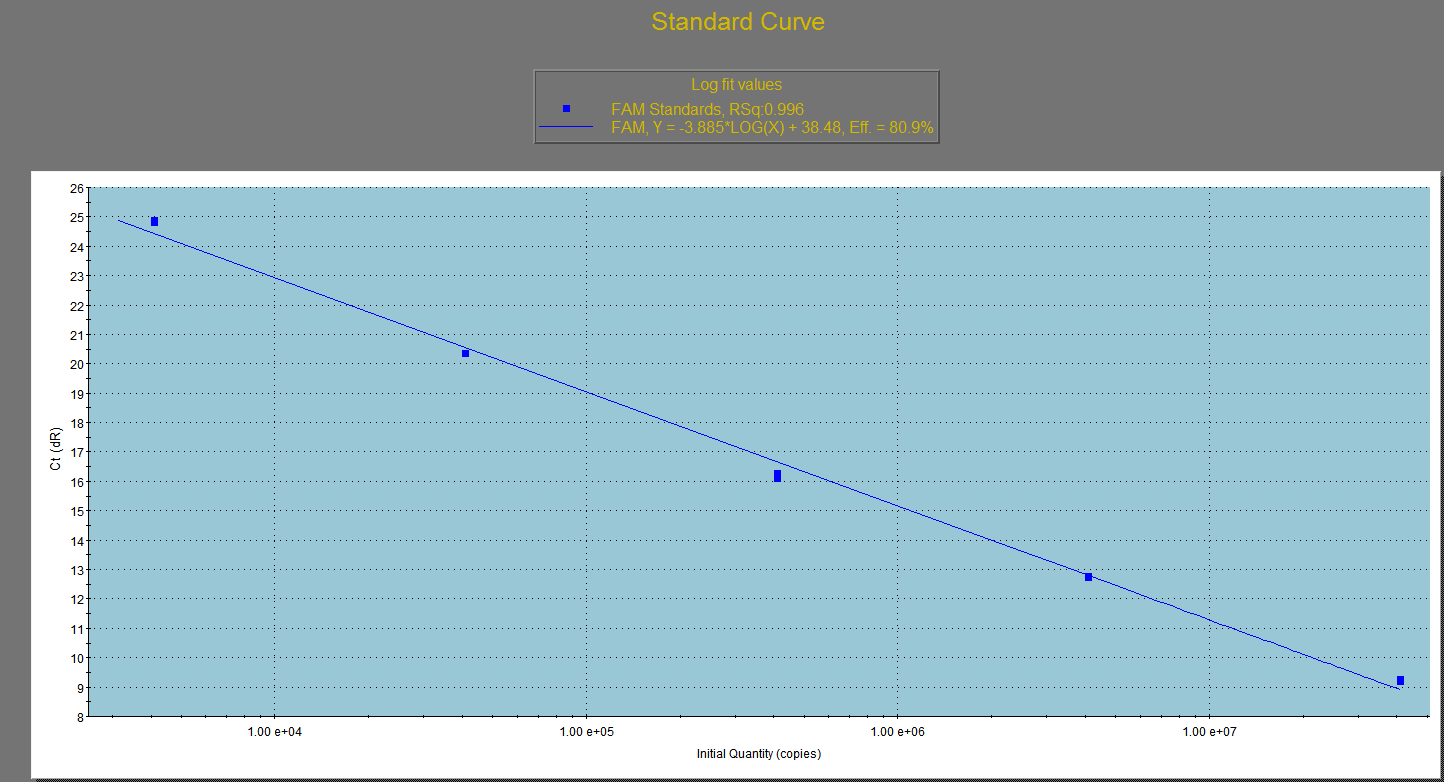
内参的标准曲线
病毒基因的标曲:
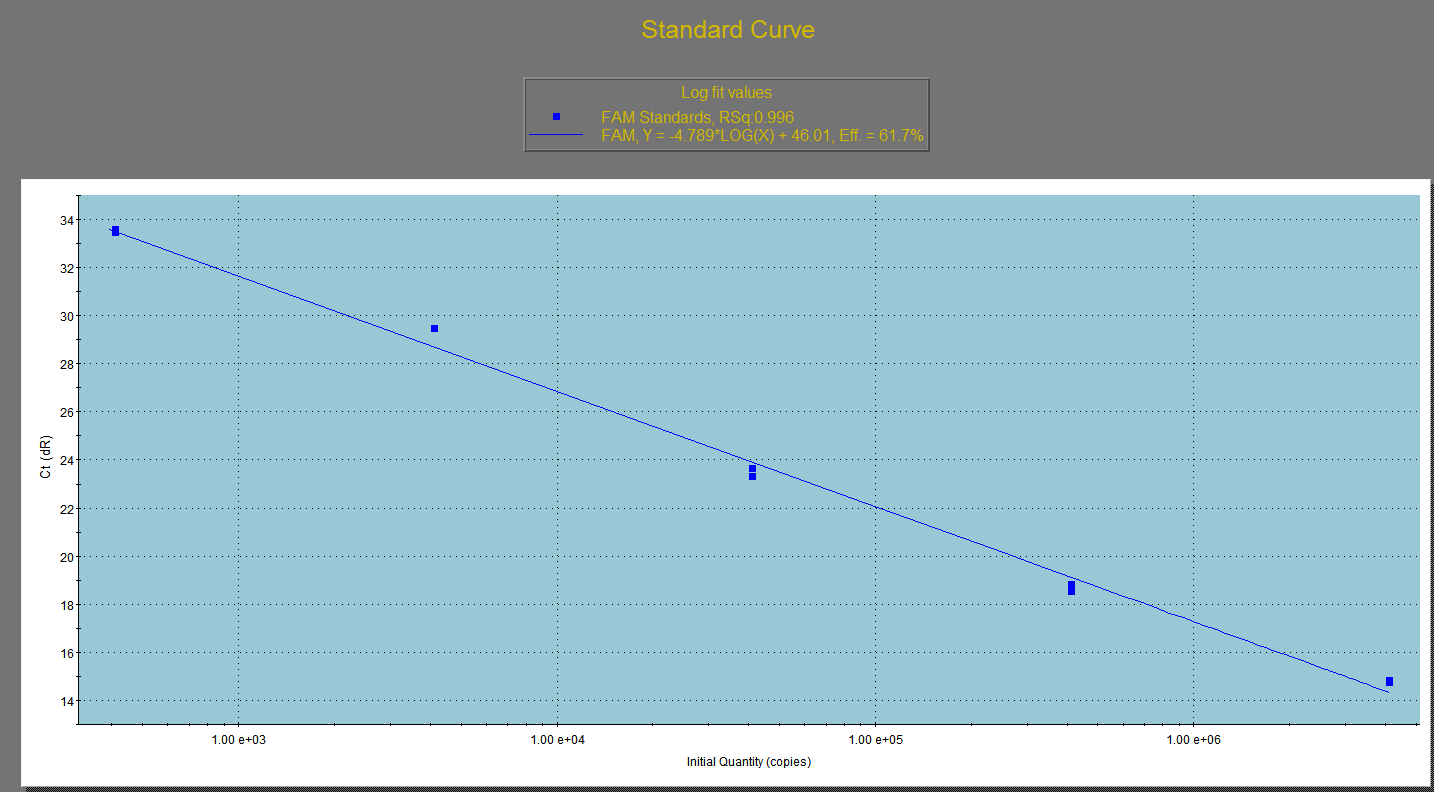
病毒基因的溶解曲线:
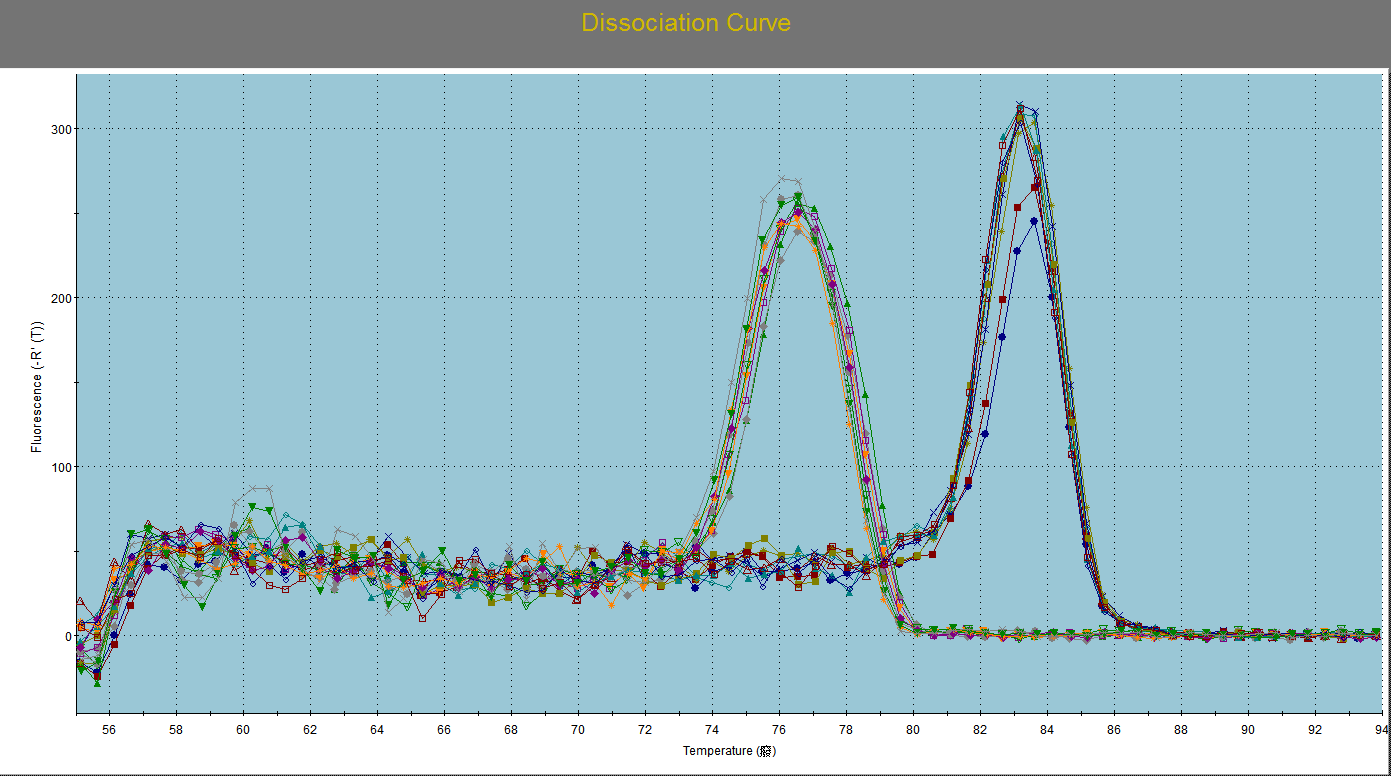
病毒滴度结果:
平均每个细胞所含病毒基因数(M1)=病毒基因拷贝数/内参基因拷贝数
病毒滴度(TU/ml)=(细胞数×稀释倍数×M1)/添加病毒体积(mL)×校正系数×1000
病毒名称
内参基因copies
病毒基因copies
M1
细胞数
滴度(TU/ml)
hsa_circ_×××
××E+03
××E+04
××
××E+05
××E+08
××E+03
××E+04
1. 慢病毒包装的辅助质粒是?
二代辅助质粒:pMD2.G和psPAX2,三代辅助质粒:PLP1、PLP2、PVSV-G
公司目前用的是二代系统。
2. 什么是感染复数(MOI)?
感染复数(MOI) 指感染细胞时一个细胞的病毒感染单元。在实验中某种细胞感染达到80%时的 MOI定义为这种细胞的最适MOI (实际使用MOI根据实验要求而定)。
简而言之,MOI是指感染指数,指病毒对细胞的感染能力;MOI越高,细胞越难被感染。
慢病毒感染MOI计算:
MOI=(病毒滴度×病毒体积)/细胞数目。举例:滴度1x10^8 TU/ml 的慢病毒感染HEK293细胞所用培养基体积和病毒量;假如24孔板细胞接种量是5x10^4个,6孔板细胞接种为2x10^5个,T25瓶细胞接种量5x10^5个。
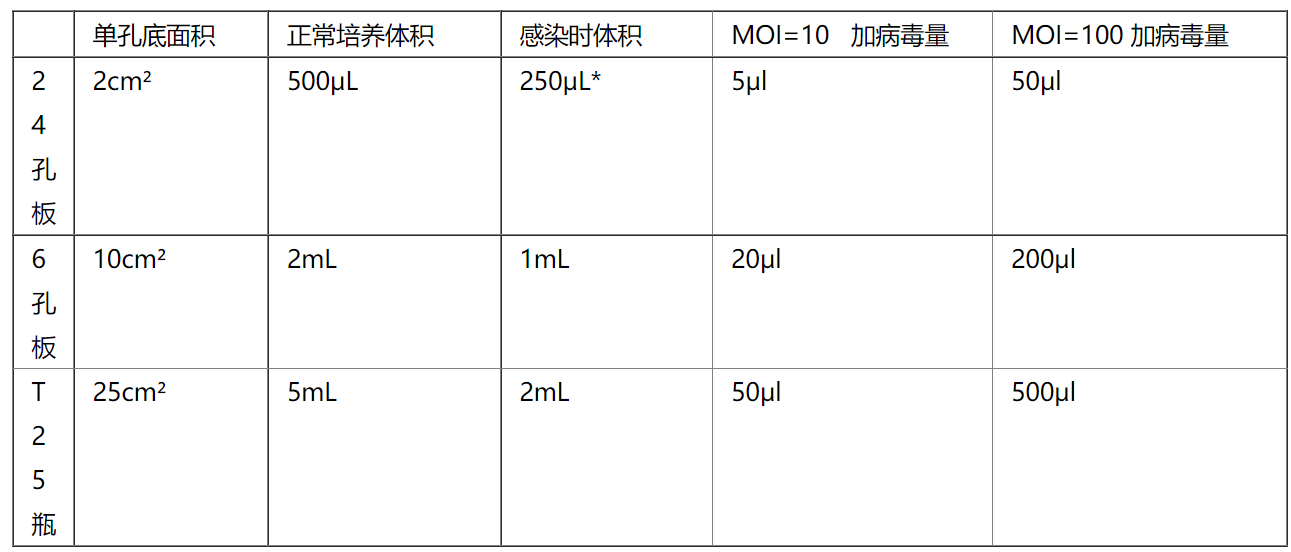
在使用慢病毒之前可以通查阅相关文献,了解慢病毒对目的细胞的亲嗜性,感染复数(MOI值)以及在体内注射所需要的病毒量。如果没有相关文献支持,可以通过感染预实验得到合适的感染复数 ( MOI 值)。
3. Puromycin在慢病毒感染的筛选中的作用机制?
Puromycin是来源于Streptomyces alboniger的一种氨基核苷类抗生素,中文名为嘌呤霉素,常用于筛选通过质粒转染/转化、病毒感染等方法能表达pac基因(puror)的真核或原核多克隆或单克隆细胞。Puromycin不仅用于稳定细胞株的筛选,也用于稳定细胞株的维持。
Puromycin的特点是快速作用于细胞,一般2天内可以杀死99%的不表达pac基因的细胞。
4. 质粒包装完慢病毒再感染细胞,整合到目的细胞染色体上的是整个质粒的线性序列吗,还是若干个线性的质粒片段?
以pLC5为例,是以过表达3‘LTR至5’LTR段包装到慢病毒基因组上,而慢病毒基因组是随机整个整合到宿主基因组上的。出现某些基因如GFP表达比目的基因表达高的情况,是因为各自的启动子(CMV\EF1a)整合到宿主基因组上后效率不同所致,而且环化RNA的环化也在经过慢病毒包装、整合宿主基因组以及在宿主环境中目的基因表达及环化装配等层层过程中衰减很多。因此稳转株过表达效率要比过表达质粒的过表达效率低很多。
5. 用PLC5-ciR质粒包的慢病毒,做了细胞功能性实验,也就是病毒感染细胞后流式测GFP,发现空载质粒的GFP信号在有些细胞系中随时间变化而下降的厉害,是什么原因?
一般情况下,病毒整合到基因组会稳定表达GFP。通过GFP的表达量越来越少可知,这个基因在瞬时表达几代后传代丢失了。建议先进行稳株筛选,除了GFP外还需要一个筛选基因如puro,药杀几代后都带绿色荧光的话基本就稳定整合到基因组了。如果不做筛选,传几代后,基因信号自然会下降直至消失。
填写需求描述给我们
工具快速咨询
400-8989-400
geneseed@geneseed.com.cn

 购物车
购物车





 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn