- ·
RNC-seq
- 产品介绍
- 案例解析
- 结果展示
- 送样建议
服务介绍
对与核糖体结合的正在翻译的全长RNA进行测序,可以进一步深化转录组研究,直接在翻译水平对应生物表型,可知哪些基因正在翻译,以及翻译起始效率;可通过翻译机制研究弥补转录组测序差异表达基因过多或过少的问题;同时也可以分析来源于circRNA或lncRNA的ORF,预测可能翻译的circRNA,且较之Ribo-seq捕获的短片段具有更高的灵敏度,能更容易获得circRNA的信号。
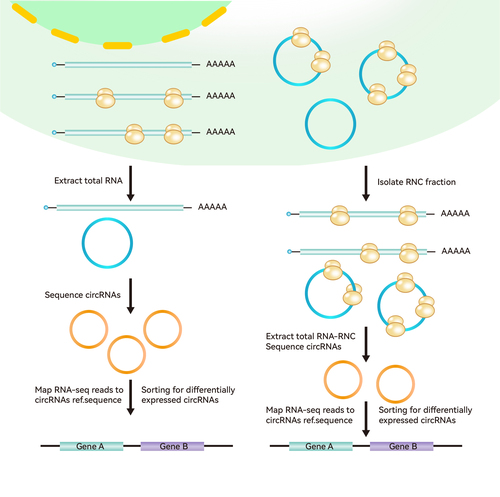
核糖体-新生肽链复合物测序技术路线
测序方案
测序平台:Illumina Novaseq 6000/NovaSeq X Plus
测序模式:PE150
测序数据量:10 Gb raw dataA peptide encoded by circular form of LINC-PINT suppresses oncogenic transcriptional elongation in glioblastoma
NATURE COMMUNICATIONS(2018),DOI: 10.1038/s41467-018-06862-2
测序策略:RNA-seq + RNC-seq
该研究对人的正常细胞和胶质瘤细胞分别进行转录组测序(RNA-seq)及翻译组测序(RNC-seq),通过测序数据分析,总共识别了15189个circRNA分子,其中7017个来自RNA-seq数据,12863个来自RNC-seq数据。对两组样本数据中显著差异表达的circRNA分子取交集,初步筛选出了320个circRNA分子(图1)。由于大部分circRNA的CDS区域与其编码蛋白的母基因相同,为了排除假阳性数据的干扰,研究团队主要关注来源于非编码基因的10个候选circRNA分子。进一步通过蛋白编码能力预测发现了5个具有蛋白编码能力的circRNA分子。最终研究团队选择来源于LINC-PINT基因的circRNA进行后续研究。该circRNA可以编码一个87个氨基酸的多肽(图2),这个多肽可直接与聚合酶相关因子复合物(PAF1c)相互作用,抑制多癌基因的转录延伸。该多肽及其相应的circRNA表达水平在胶质母细胞瘤中较正常组织降低。研究结果证实了circRNA编码的肽段的存在及其在胶质母细胞瘤发生发展中的潜在功能。
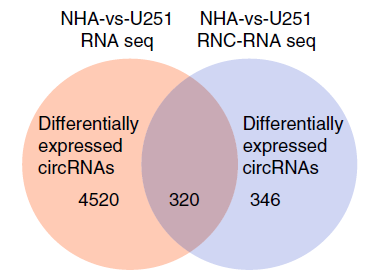
Figure1. 两种测序显著差异表达的circRNA分子取交集
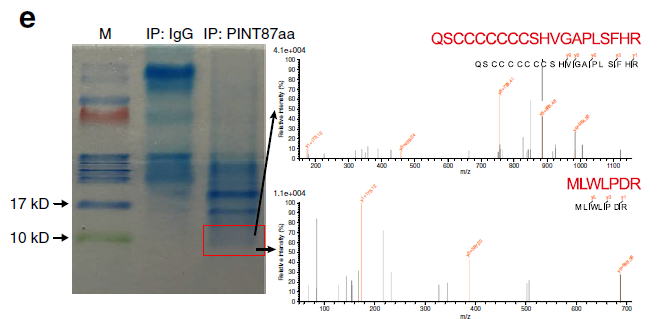
Figure2. 特异性抗体IP实验及LC-MS/MS分析鉴定PINT87aa多肽序列
生物信息分析
基础分析
原始数据质控检查
比对结果质控检查
基因覆盖度分析
基于基因表达的样品主成分分析
基因表达分析
差异基因表达分析
差异基因GO功能分析
差异基因KEGG通路分析
差异基因Rectome通路分析
针对mRNA基因的GSEA分析
circRNA预测及鉴定
circRNA差异分析
差异circRNA宿主基因的GO功能分析
差异circRNA宿主基因的KEGG通路分析
差异circRNA宿主基因的Rectome通路分析
差异circRNA的靶向miRNA预测分析
差异circRNA及靶向miRNA网络调控制图
长链非编码RNA的识别
长链非编码RNA差异分析
差异lncRNA顺式调控基因的GO功能分析
差异lncRNA顺式调控基因的KEGG通路分析
差异lncRNA顺式调控基因的Rectome通路分析
高级分析
circRNA翻译潜能预测分析
翻译效率分析
*可选择只测circRNA的方法步骤进行实验,详询技术支持
部分结果示例
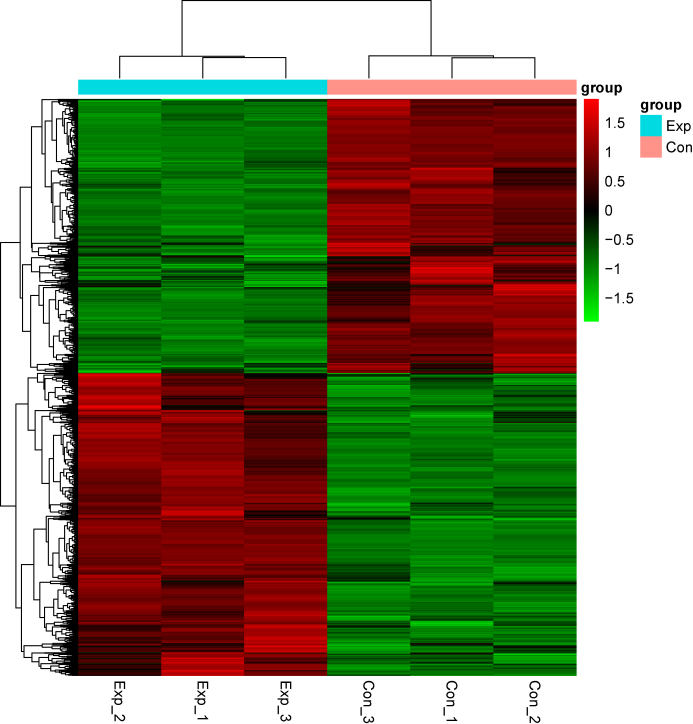
图1. RNC-seq差异表达基因热图展示
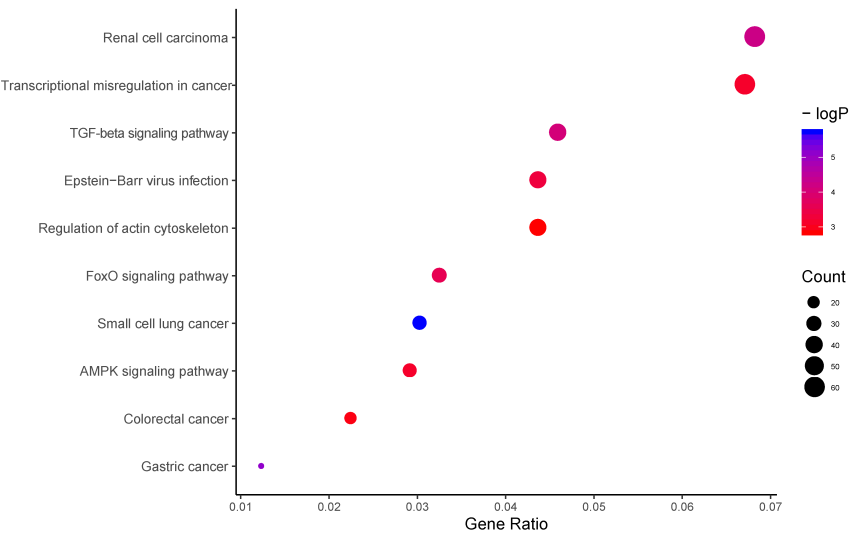
图2. RNC-seq差异表达circRNA的KEGG通路富集图展示

图3. RNC-seq的circRNA-miRNA网络图展示
Table1. RNC-seq原始样本送样建议
送样类型
送样量
备注
细胞(细胞数)
≥1*10^7
无支原体污染
动物组织
≥100mg
植物组织
≥100mg
*翻译组测序的细胞样本处理方法和转录组测序不一样,具体处理、保存和运输方法请咨询技术支持。
物种范围:人、小鼠、大鼠,其他物种请详询销售或技术支持
填写需求描述给我们
工具快速咨询
400-8989-400
geneseed@geneseed.com.cn

 购物车
购物车





 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn