- ·
荧光素酶报告检测
- 产品介绍
- 案例解析
- 结果展示
- FAQ
服务介绍
荧光素酶报告实验是指以荧光素为底物来检测荧光素酶活性的一种报告基因系统,通过荧光测定仪检测该报告基因系统中释放的生物荧光,从而反映基因是否存在靶向互作。
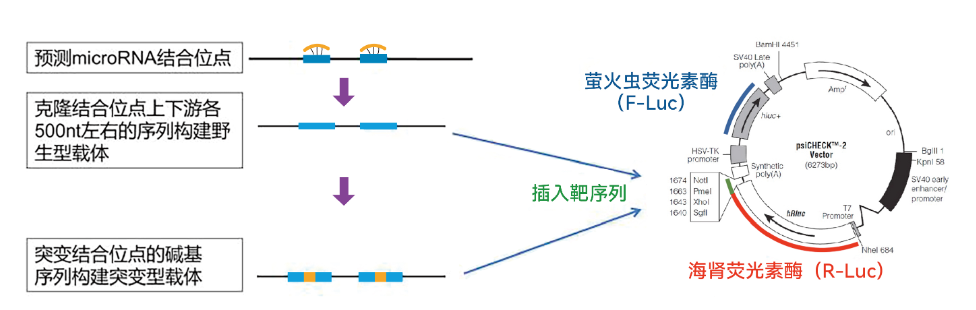
技术优势
1. 灵敏度高,比Western blot灵敏度高1000倍以上;
2. 内源性低,哺乳动物无内源性表达;
3. 荧光素酶检测不受细胞内其他物质影响;
4. 发光检测,检测方便;
5. 检测范围广;
6. 采用瞬时转染技术,操作简便、快速,周期短,适用于绝大多数细胞类型。
客户提供
1. circRNA可提供circBase/circBank ID;mRNA/lncRNA可提供转录本ID(如NCBI编号NM_001126113.2);
2. 结合位点信息:预测结合位点图片或文档(具体序列);
3. 检测使用的细胞;
4. 双荧光素酶检测的分组信息。
我们提供
1. 质粒10μg+菌液200μl;
2. 载体构建+双荧光素酶实验报告;
3. 剩余的模拟物。
案例1
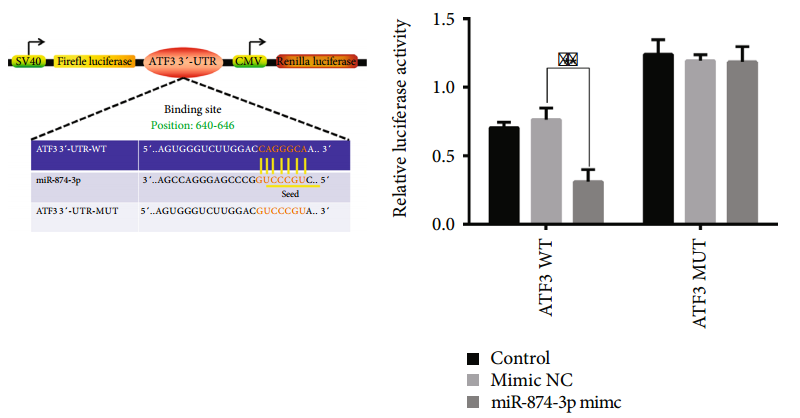
参考文献:
Li Y, Pan D et al. Silencing ATF3 Might Delay TBHP-Induced Intervertebral Disc Degeneration by Repressing NPC Ferroptosis, Apoptosis, and ECM Degradation. Oxid Med Cell Longev. 2022 :4235126.
案例2
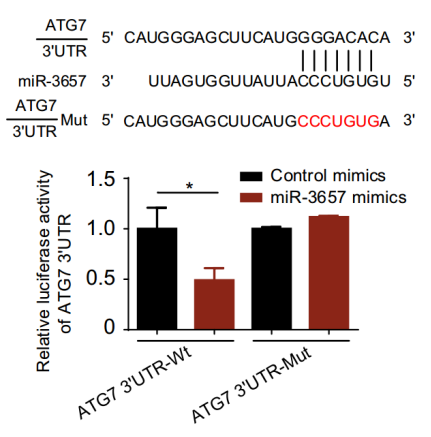
参考文献:
Ma L et al. Silencing of circRACGAP1 sensitizes gastric cancer cells to apatinib via modulating autophagy by targeting miR-3657 and ATG7. Cell Death Dis. 2020 , 11(3):169.
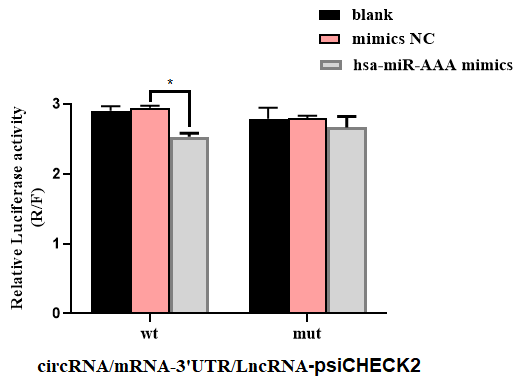
模拟物与靶基因作用情况
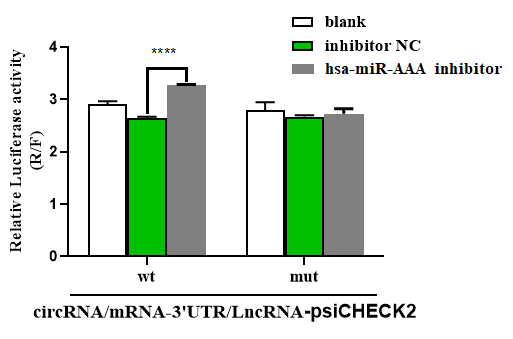
抑制剂与靶基因作用情况
1、双荧光素酶实验检测数值太低是什么原因?
正常表达水平下,荧光值的数量级应在10 4次方-10 7次方数量级左右,导致数值低主要有以下几个原因:启动子活性、转染效率低、裂解不充分、底物失效、操作不规范等原因,具体的原因需要实验者进行排查。
1.1 转染效率低
a. 优化转染实验条件,用较易转染的质粒做阳性对照(如转染过表达荧光蛋白质粒);
b. 确保转染DNA的质量,可通过酶切或琼脂糖凝胶电泳的方法对DNA质量进行鉴定;
c. 选择活性较高,处于指数分裂期的细胞进行转染。
1.2 启动子活性低或诱导失败
a. 转染后的细胞培养使用特异性诱导启动子的条件;
b. 优化细胞的培养条件,提高荧光素酶的表达量;
c. 更换强启动子(如SV40、CMV)。
注:海肾荧光素酶基因作为内对照,其表达应不受时期、部位、环境影响,因此常用组成型表达的TK启动子。
1.3 样品裂解效率低
a. 细胞培养时间不宜过长,12-36h内最好,长时间培养后,细胞可能会难裂解。
b. 加入的裂解液需足量,保证细胞能够充分裂解。
1.4 检测过程操作不规范
a. 选择合适的检测仪器,能够检测化学发光或者生物发光的仪器都适用于该实验;
b. 需加入足量底物,保证底物的饱和,否则会造成检测结果出现很大偏差;
c. 室温反应。反应时各个组分(细胞裂解产物,底物工作液等)都需要调整到室温;
d. 荧光素酶的半衰期一般约30min,加完底物后可立即检测,尽量在30min内完成裂解。
1.5 底物氧化失效
a. 底物避光密封保存,萤火虫荧光素酶底物-20℃保存;海肾荧光素酶底物推荐-80℃保存;
b. 反应工作液建议现用现配。
2、双荧光素酶荧光值过高的原因?
荧光值过高可能会超出仪器检测范围,从而检测不到值,一般读数在5-6位之间较好。荧光值过高可通过以下方式尝试解决:
a. 减少质粒转染量;
b. 细胞样品裂解后,离心取上清后检测或对裂解产物进行稀释后检测。
注:不建议通过减少底物量来降低荧光值,需要保证底物的饱和来反映荧光素酶真实的表达水平,否则会造成检测结果出现大的偏差。
3、双荧光素酶复孔差异大怎么办?
双报告基因检测系统较为灵敏,检测结果受多种因素的影响,因此,一般设置3个或3个以上的复孔,复孔之间有差异是正常的,差异在同一个数量级可以接受。想要得到更准确的实验结果,需尽量减少复孔的差异性,建议如下:
1、裂解后建议离心取上清,保证样本均一性;
2、保证加样的准确性;
3、样品和底物混合后到检测前的时间以及检测时间应控制在相同的时间内。
填写需求描述给我们
工具快速咨询
400-8989-400
geneseed@geneseed.com.cn

 购物车
购物车




 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn