- ·
蛋白组质谱
- 产品介绍
- 送样建议
服务介绍
蛋白质是生命功能的执行者,直接体现生命活动的多样性和复杂性。蛋白质组学研究是指在大规模水平上研究蛋白质的特征,蛋白组研究可以反映、注释和表征特定表征或疾病相关的蛋白质,为预测、诊断、治疗和预防医学应用发展奠定基础。
蛋白组研究主要内容
蛋白质定性与定量分析;蛋白质功能研究;翻译后修饰;亚细胞定位;参与的代谢途径;蛋白质与蛋白质或其它分子间的相互作用。
蛋白组研究应用领域
(1)基础医学/生物医药领域
① 诊断标志物发现:筛选和鉴定疾病特异的生物标记分子,作为疾病诊断、预后效果等的重要证据。
② 治疗靶点挖掘:识别与健康或疾病相关的蛋白质作为潜在治疗或预防靶点,分析蛋白质靶点的可药性,针对靶点设计和开发新药。
③ 新药研发:一方面可以研究候选药物成分,另一方面可以联合转录组信息分析药物作用机理和毒理,筛选有效药物,改进药效和药物安全性。
④ 调控机制研究:研究蛋白质之间、DNA/RNA与蛋白质之间的相互作用,分析基因之间的协同和拮抗作用,理解生物网络和系统生物学。
⑤ 蛋白质结构研究:针对未知蛋白质或多肽,分析其氨基酸序列并预测空间结构,以及研究其功能作用,改进基因注释,发现新基因功能等。
⑥ 发病机制与病理进程研究:研究疾病发生时的蛋白质分子变化,以及不同病理阶段分子水平的差异,揭露疾病发生的分子机制,促进后续药物筛选以及患者的病程管理等。
(2)其他领域
①农林:抗逆胁迫机制,生长发育机制,育种保护研究等。
②畜牧业:肉类及乳制品等品质研究,致病机理研究等。
③微生物:致病机理,耐药机制,病原体-宿主相互作用研究等。
蛋白组研究策略
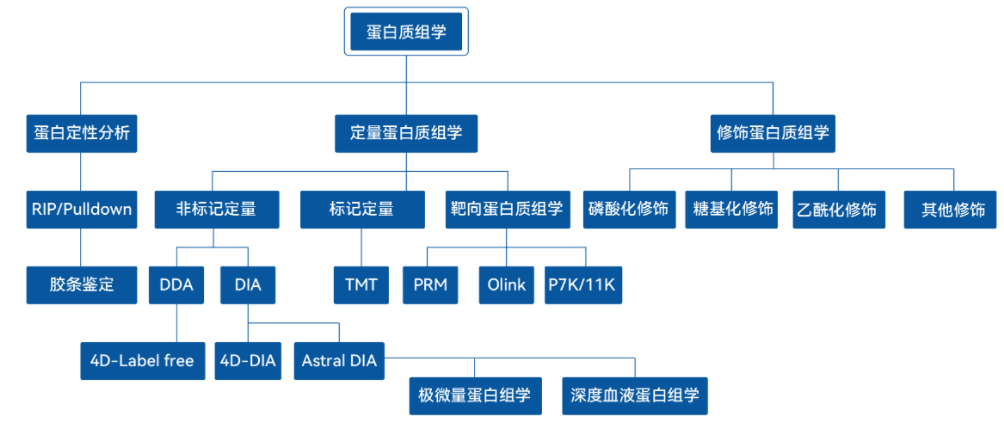
(1)非靶向蛋白质组学
又称发现蛋白质组学,不需要事先了解目标蛋白的信息,能够对蛋白质样本进行全面高通量的定量和鉴定,可以同时检测和分析样本中的多个蛋白质,更关注蛋白质筛选和动力学。数据依赖性采集模式(Data dependent acquisition,DDA)和数据非依赖性采集模式(Data independent acquisition,DIA)是质谱分析中常用的两种数据采集模式。
DDA:在一级质谱的每个时间窗口进行检测循环时,选择性采集信号相对较强的肽段离子进入二级质谱碎裂。因此,DDA无法有效的采集到信号强度较弱的信号离子,限制了检测灵敏度,采集结果具有一定随机性,无法对大量样品完成可重复性的位点分析。
代表性技术:
① 4D-Label-free:无需化学标签(如同位素)标记肽段;DDA采集模式;利用四维(保留时间、质何比、离子强度、淌度)分离离子,可鉴定蛋白的有无情况。
② TMT:通过同位素标签标记肽段;DDA采集模式;混样上机,可消除批次效应。
DIA:采集所设置的最低强度值以上的所有肽段离子进行二级质谱分析,遗漏的数据少,准确性更高。
代表性技术:
① 4D-DIA:4D和label free蛋白组技术基础上,采用DIA采集模式,覆盖度、稳定性好。
② Astral DIA:基于新一代Orbitrap Astral高分辨质谱仪,结合了四极杆质量分析器(Quadrupole)、轨道阱质量分析器(Orbitrap)以及全新非对称轨道无损质量分析器(Astral),分辨率、灵敏度、覆盖度、稳定性全方面提升。
Astral DIA蛋白组学优势
l 高覆盖率:2ug Hela细胞裂解液60min扫描梯度,能测定12000多个蛋白;
l 高灵敏度:250pg Hela细胞裂解液18min扫描梯度,能测定5335多个蛋白;
l 高稳定性:针对真菌和E.coli多样本分析,88%鉴定蛋白CV<20%,75% CV<10%;
l 检测速度快,周期短:1天可测定180个样本,共获得147万多个蛋白。
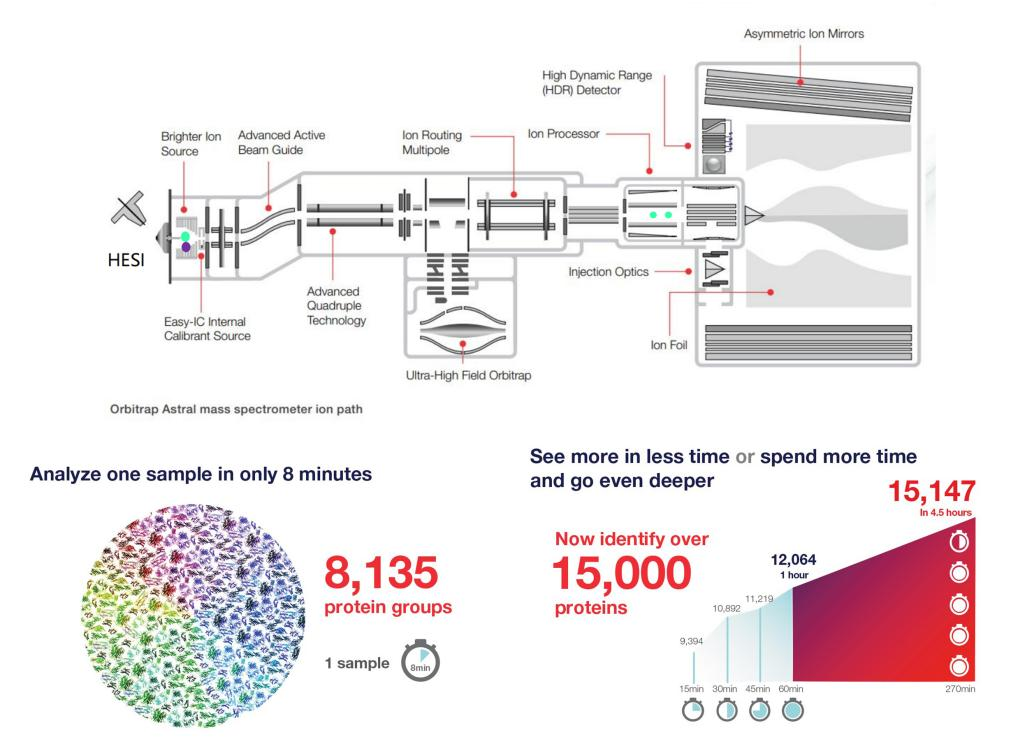
(Source:https://www.thermofisher.com/)
(2)靶向蛋白组学
通过预先选择目标蛋白针对性的分析复杂混合物,进行定量和分析,类似ELISA或Western blot等技术,更侧重于检测目标蛋白质/多肽的绝对定量。
代表性技术:
① P7k/11k:化学合成并修饰得到DNA适配体(Aptamer),筛选出针对目标蛋白特异性识别的适配体。能达到与单克隆抗体相当的亲和力,进而对目标蛋白进行广泛、特异、准确地定量分析。
② Olink:基于PEA技术(Proximity Extension Assay,PEA)的靶向高敏微量体液蛋白质组学,通过抗体对目标蛋白特异性识别、结合抗体末端寡核苷酸序列的扩增,实现对疾病与生理过程中血清、血浆等各类体液样本中目标蛋白的定量分析。
③ PRM:基于LC-MS/MS的靶向蛋白质分析技术,能够对目标蛋白、目标肽段(包括发生翻译后修饰的肽段)进行高选择性、高特异性、高重复性和高准确性检测,实现对目标蛋白/肽段的相对或绝对定量分析。
动物组织类:常规动物组织(脑、心、肝、脾、肺、肾、肌肉、皮肤等)、软体动物(血吸虫、旋毛虫等)、脂肪组织(白色)、动物坚韧组织-软骨、动物坚韧组织-硬骨、动物坚韧组织-毛发、FFPE (石蜡切片)、活检穿刺组织;
植物组织类:软组织(木本植物的叶、花等,草本科植物,藻类,蕨类植物,大型真菌等)、木本科植物的树根、树皮、树枝等、果实、种子、花粉;
微生物类:菌类;
细胞类样品:悬浮培养细胞、贴壁培养细胞、亚细胞器样本(如线粒体等);
体液类:血清、血浆、动物乳汁或人乳汁、乳脂肪球膜蛋白(MFGM)(即脂质层)、脑脊液、关节液、淋巴液、附睾腔液、唾液、泪液、尿液、房水、玻璃体液、肺泡灌洗液;
其他类:分泌蛋白、细胞上清;
注:以上仅为参考样品类型,具体送样建议请联系公司专业人员。

 购物车
购物车





 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn