
- 首页
- >
- GENESEED
- >
环状gRNA增强靶向RNA修饰,推进过早终止密码子疾病的RNA疗法开发
RNA的功能是由上百种修饰调控的。RNA修饰加深了我们对RNA控制细胞功能的理解,并为推进合成生物学领域提供了巨大而未开发潜力。
最丰富和功能最通用的RNA修饰之一是假尿嘧啶(5-核糖体尿嘧啶,Ψ),尿嘧啶的异构体。Ψ与尿嘧啶的结构差异:C-N糖苷键向C-C键的异构化,使Ψ具有形成额外氢键的可能性,并有助于稳定RNA。
在体外转录mRNA中,Ψ修饰作为一种有效的翻译增强剂。此外,当Ψ位于终止密码子时,可抑制终止密码子,这可靶向很多过早终止密码子引起的遗传病,如囊性纤维变性。而依赖于限制内源性因素或假尿嘧啶合成酶的过度表达的针对性治疗策略,可能会导致不必要的脱靶效应。
H/ACA box小核仁RNA(snoRNAs)可与假尿嘧啶合成酶(DKC1)形成复合物,作为引导RNA(gRNA)。这些H/ACA box小核仁RNA都有反义引导序列形成特征性“泡”的二级结构。这些假尿嘧啶修饰“泡”可设计成与任何靶RNA互补,依赖gRNA的DKC1成为ΨRNA修饰编辑细胞器的理想候选者。
近日,德国美因茨分子生物研究所Edward A.Lemke研究团队在Nature Communications期刊上发表研究论文:Selective RNA pseudouridinylation in situ by circular gRNAs in designer organelles。研究使用RNA引导的DKC1构建了一个RNA修饰细胞器,实现mRNA选择性Ψ修饰。此外,研究利用环状gRNA显著增强了mRNA假尿嘧啶修饰,并通过Ψ修饰靶向抑制终止密码子,为从合成生物学到RNA治疗提供了新的可能性。

结果
设计细胞器增强终止密码子抑制
研究利用源自非洲爪蟾(Xenopus laevis)H/ACA box RNA pugU2-34/44的gRNA,通过设计gRNA,靶向iRFP-eGFP39TAG报告基因,该报告基因只有在提前的终止密码子上发生Ψ修饰才会产生eGFP。
研究在正交翻译膜样细胞器的设计基础上设计细胞器,用啮齿动物LCK酪氨酸激酶(LCK)的n端结构域作为质膜(PM)锚点(图1),蛋白质FUS衍生的内在无序区域(IDR)和主要衣壳蛋白(MCP)作为募集结构域。利用dyskerin在N或C端缺少NLS/NoLS信号的截断形式(aa 22-424,DKC1),并在N端增加了一个核输出信号(NES)。
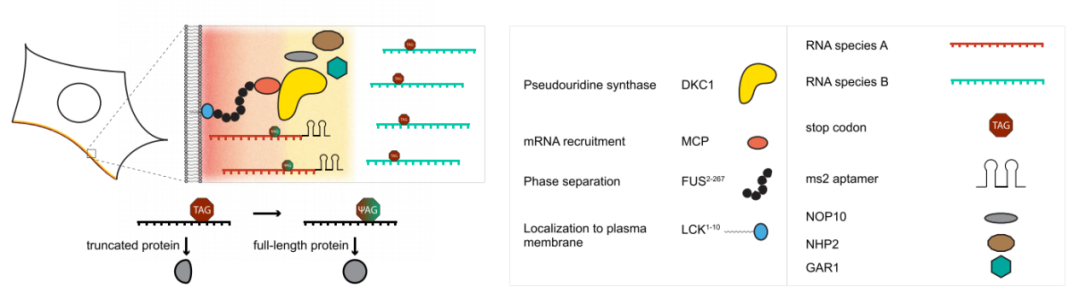
图1 选择性RNA修饰的膜样细胞器。
研究利用含有ms2噬菌体3'UTR中的两个RNA茎环的iRFP-eGFP39TAG报告基因(效率报告基因)(图2b),RNA茎环可与细胞器结构中的MCP特异性结合,选择性招募效率报告基因。效率报告基因通过ms2/MCP标记系统被显著招募;当与gRNA共转染时,可介导终止密码子抑制;而缺乏IDR或MCP的LCK-DKC1构建体的效率较低(图2b,c)。
进一步研究发现,与表达NAS-DKC1的细胞相比,承载设计细胞器的细胞选择性增加了2.5倍以上(图2d,e),这种效果依赖于ms2茎环。
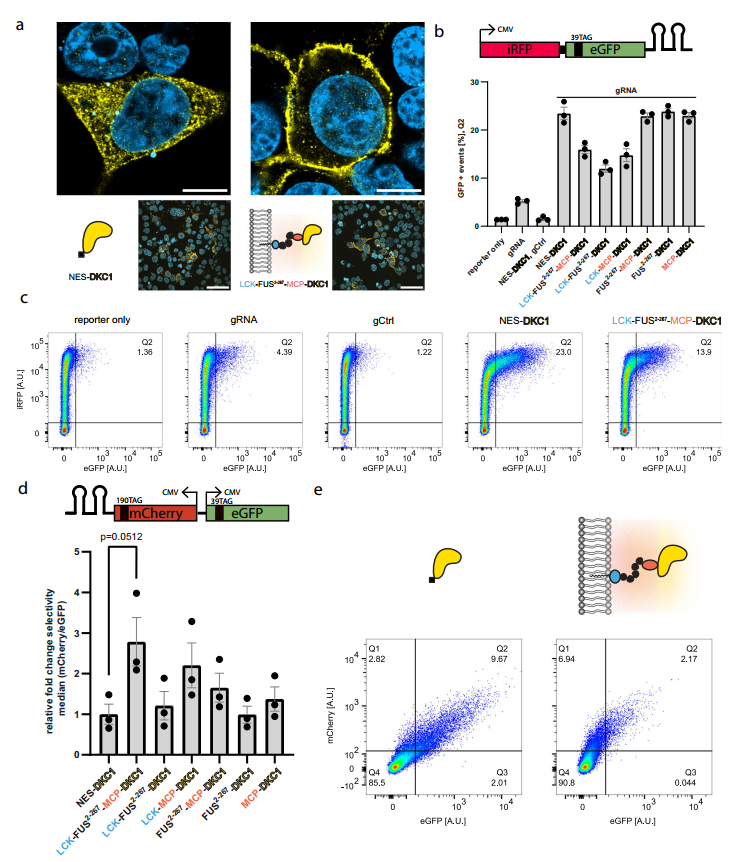
环状gRNA显著增强终止密码子抑制
为了优化细胞器对假尿嘧啶依赖的终止密码子抑制的效率,作者受到环化适配体策略的启发,利用twister核酶自剪切,体内形成环状gRNA。
在设计细胞器中,环状gRNA显著增加了GFP阳性细胞的数量(增加了10%)(图3b,c)。这种效果可能由于环状gRNA对外切酶有更大的抗性,积累的水平显著高于线性对应物;也可能由于环状RNA优先从细胞核中输出,而DKC1结构位于细胞质中,这使得环状gRNA的修饰效率更高。
研究进一步设计环状gRNA,在gRNA中添加不同ms2茎环5’和3’,使其可被招募到REO中;并设计了LCK-FUS2-267-4xλN22-FUS2-267-MCP-DKC1细胞器,其中包含四个重复的λN22肽。结果发现,当使用环状gRNA优化的RNA编辑细胞器(OREO)时,选择性修饰进一步提高到4倍。
研究还测试了另外三种曾被应用的膜锚来形成OREO。结果发现,这些OREO靶向高尔基、ER和线粒体的表现与(PM锚定细胞器)LCK相似。
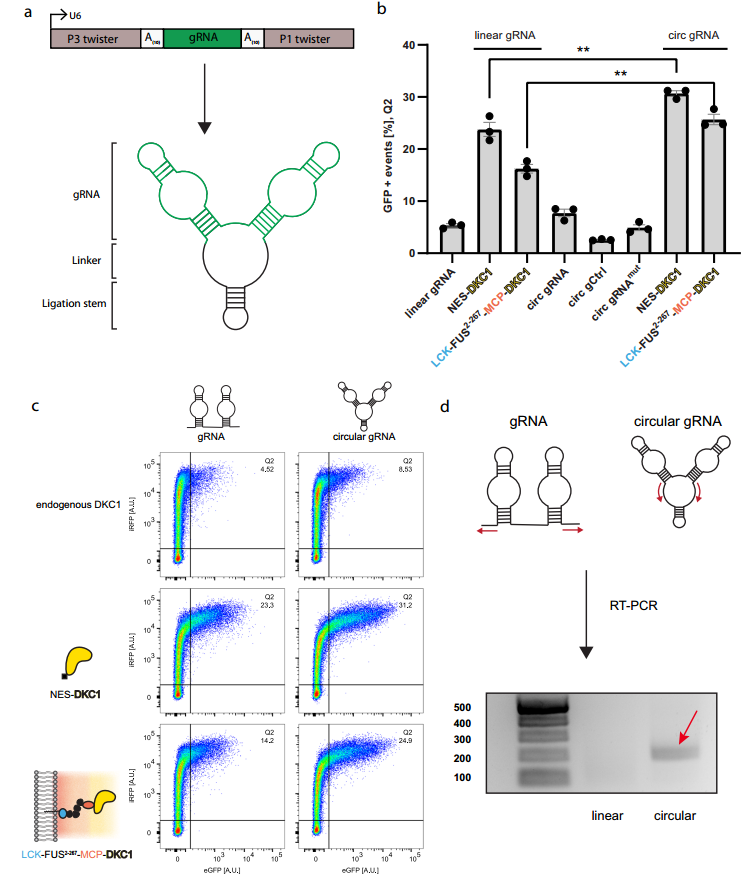
图3环状gRNA可增强假尿嘧啶介导的终止密码子抑制。
环状gRNA选择性假尿嘧啶修饰
研究发现携带细胞器的细胞可保持高选择性(图4a),优先产生mCherry,而环状gRNA的增强作用更为明显,与使用线性gRNA的REO相比,平均增加了一倍以上(图4b,c)。
进一步使用牛津纳米孔技术公司(ONT)的直接RNA测序(Direct RNA测序;DRS),检测RNA的假尿嘧啶修饰。DRS可进行天然RNA测序,而无需进行事先扩增步骤。在测序过程中,通过检测特定的电流变化,识别碱基。DNA或RNA碱基修饰的电信号模式不同于其对应的标准碱基,因此可通过分析电信号,可识别碱基修饰。
ONT测序小知识
文中利用牛津纳米孔技术(ONT)的直接RNA测序检测假尿嘧啶修饰。ONT测序是新一代基于纳米孔的单分子实时电信号测序技术,DNA/RNA分子的不同碱基通过Nanopore,产生不同的电信号变化特征,对这些特征信号进行检测和比对,即可获取相应的碱基类型。吉赛可提供circRNA全长、Direct RNA、cDNA-PCR、16S rDNA等一系列的ONT三代测序服务,助力碱基修饰检测及复杂序列全长分析!
Nanopore三代测序优势
①超长读长:读长超二代测序,能鉴定更多遗传变异,应用更广;
②高准确性:不需PCR扩增测序,避免了扩增过程造成的偏差和错配;
③直接测序:保留原始碱基修饰信息,能直接读出碱基的修饰;
④实时测序:快速测序和分析,可体现实时响应的结果;
⑤高灵活性:可适用多种类型样品,可使用独立芯片处理样品,无需批量样品上机。
相关阅读:测序早已进入Next level——Nanopore三代测序,你了解吗?
最常见的假尿嘧啶修饰模式是系统性尿嘧啶-胞嘧啶错配,即假尿嘧啶被检测为C。根据碱基错误信息可将单个reads分类为未修饰和修饰的,从而可量化特定位点的伪尿嘧啶修饰。模拟目标序列,研究合成完全修饰的RNA寡核酸,进行DRS测序,验证了DRS的适用性。
然后,提取了选择性实验细胞的poly-A RNA(图4c),利用ONT直接RNA测序,读取碱基调用错误模式,包括U-C错配。DRS结果与流式细胞术数据一致,OREO靶向的位置被优先假尿嘧啶修饰,修饰水平从2.9倍增加到25.1倍(图4d)。
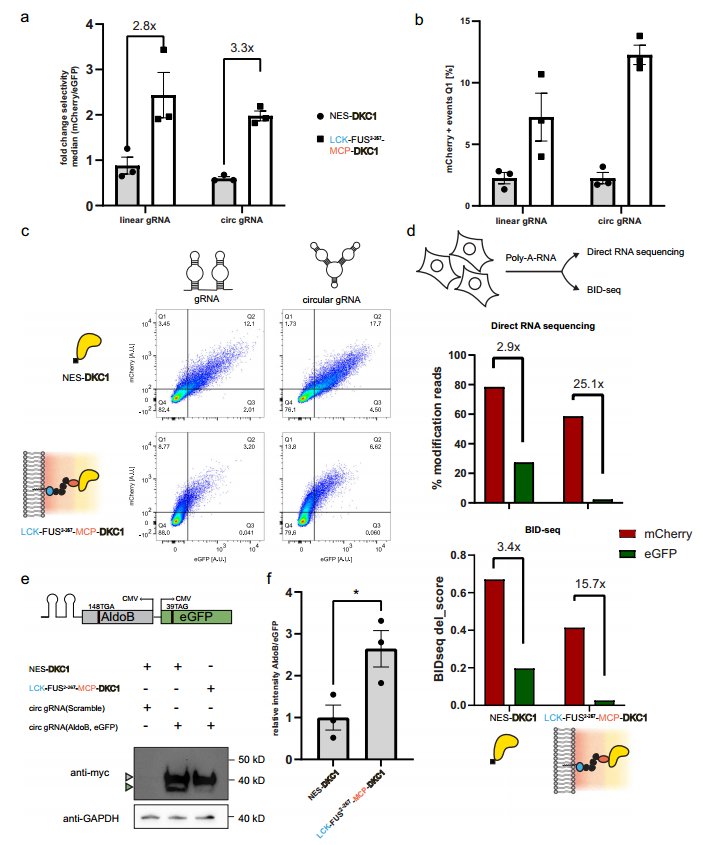
图4环状gRNA增加设计细胞器介导的假尿嘧啶修饰。
OREO修饰疾病相关mRNA
AldoB基因功能丧失突变,可导致遗传性果糖不耐受。研究设计了针对AldoB148TGA的环状gRNA。Western blot分析显示,高效的靶向修饰可诱导全长AldoB基因表达,同时大幅降低脱靶水平(图4e,f)。
总结
研究根据相分离概念设计细胞器,以高度选择性和依赖引导RNA的方式进行mRNA假尿嘧啶修饰。此外,研究使用环状引导RNA显著增强靶向假尿嘧啶化的有效性。研究通过优化RNA编辑细胞器(OREO)引入空间工程,为靶向RNA修饰的补充了新工具,为提高RNA修饰特异性提供了新的途径。
原文链接
https://pmc.ncbi.nlm.nih.gov/articles/PMC11502668/









