
- 首页
- >
- GENESEED
- >
分享丨近年用小本本记下的circRNA应用大全
2024年10月26日,转录本(上海)生物科技有限公司(RiboX Therapeutics)用于治疗放射性口干症的RXRG001环状RNA疗法的IND申请,被美国食品药品监督管理局(FDA)批准进入临床开发阶段。[1]紧接着,2024年10月30日,上海环码生物医药有限公司(CirCode)自主研发用于治疗缺血性心脏病的环状RNA药物HM2002注射液的IND申请被国家药品监督管理局药品审评中心(CDE)正式受理。
circRNA作为“黑马”明星分子,闯入人们视野;
从在植物类病毒中被发现,到在人体内被大量挖掘;
从被认为是剪接错误的副产物,到被揭示为生物功能的重要调控者;
从被定义为“非编码RNA”,到被发现可翻译;
从作为内源性RNA被研究,到作为工程化RNA被开发应用;
……
随着研究深入和应用开发,circRNA逐渐发光发亮,工程化平台更是为circRNA创造了一个更大的舞台。
工程化circRNA如何诞生的?
体外合成:体外转录得到线性RNA前体,利用化学法,或基于T4 DNA、T4 RNA连接酶、核酶(I型内含子、II型内含子自剪接核酶或顺式连接酶核酶)连接法等技术进行环化,然后纯化得到circRNA;
体内合成:将DNA质粒递送到细胞内,表达前体RNA,然后通过反向剪接和自催化切割等方法生成。
是什么让工程化circRNA如此优秀?
①稳定性高:circRNA因其环状结构,对核酸外切酶具有更强的抗性,与线性RNA相比稳定性更高,半衰期更长;
②安全性高:工程化circRNA模拟体内天然结构,无需额外的修饰,也不存在病原体识别受体(如RIG-I、TLR3、TLR7、TLR8等)的识别序列,不易引起先天免疫反应。纯化后的circRNA分子在体内免疫原性较低,副作用较低,体现其作为药物的安全性;
③原料简单:不需加帽、加尾等结构,不需要引入RNA修饰,利用有效的合成平台可大规模生产,降本增效。
④可翻译性:经过设计的circRNA,加入高效的起IRES等介导翻译起始元件、插入合适的ORF,可在体内稳定、有效翻译所需的蛋白质。
工程化circRNA在什么领域发光发热?
01 机制研究
体外合成内源表达的目标circRNA,转染到细胞中,或利用LNP、外泌体等系统递送到动物体内,可实现目的circRNA的精准、快速、可控的表达/过表达。
膀胱癌细胞来源的细胞外囊泡(EV)中存在circRNA-LIPAR,可诱导SELE过表达的淋巴重塑转移前生态位。研究利用工程化EV装载体外合成的circRNA-LIPAR,然后注射到小鼠体内,进一步验证了EV中circRNA-LIPAR的功能和机制。[2]

图1利用工程化EV装载体外合成的circRNA-LIPAR,通过脚垫注射建立工程化EV教育实验模型。[2]
02 基因或RNA编辑
基因或RNA编辑是遗传性疾病的重要治疗策略。工程化circRNA应用于基因或RNA编辑,可克服线性引导RNA和编辑器的低效率和短寿命问题,还能实现体内原位编辑。
RNA修饰
ADAR蛋白可介导腺嘌呤到次黄嘌呤(A-to-I)的RNA编辑,实现转录后修饰。设计环状向导RNA(arRNA)可招募内源性ADAR,可在体外和体内实现稳健、持久和高度特异性的A-to-I RNA编辑,平均编辑效率可比线性arRNA高约3.1倍,且效力更持久(持续长达21天)。[3]
基于环状RNA引导的假尿嘧啶合成酶dyskerin(DKC1)构建人工膜样细胞器,可显著增强靶向RNA假尿嘧啶化修饰的有效性。[4]
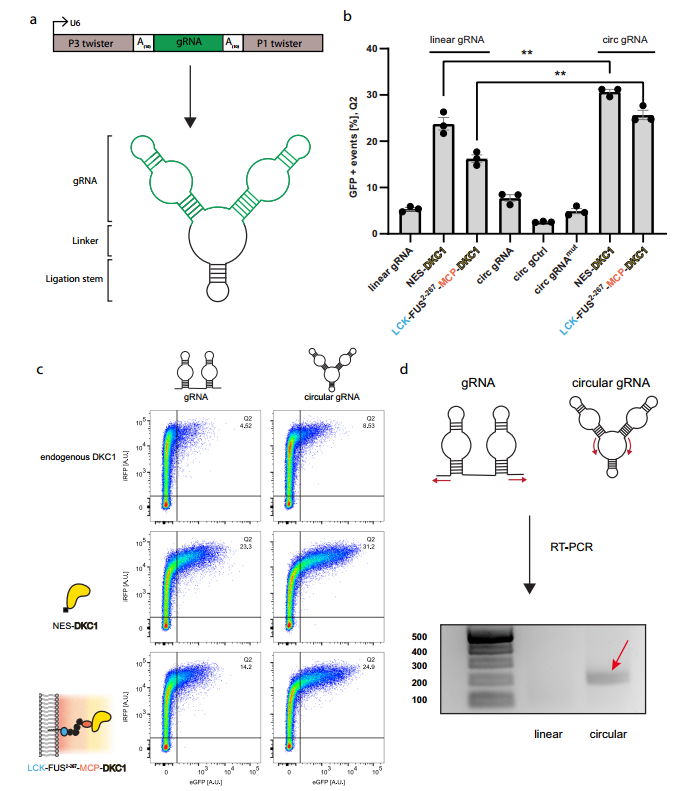
图1环状gRNA可增强假尿嘧啶修饰介导的终止密码子抑制。[4]
基因编辑
CRISPR引导编辑器能实现碱基的精准替换,及小片段的精准插入、替换和删除。利用circRNA表达CRISPR-Cas9蛋白进行基因编辑,具有相当的特异性。[5]
此外,基于ZF蛋白的基因组工程完全依靠蛋白质,尤其适合利用circRNA的表达模式。利用circRNA表达锌指核酸酶(ZFN)的可以进行有效的基因组编辑。[5]
Cas12a编辑系统与Cas9具有相似的功能,在基因治疗和农业生产也具有广泛的应用潜力。通过在circRNA中串联置入靶向多个位点的多个crRNA,以及靶向多个位点的RTT-PBS序列,可引导基于Cas12a开发的引导编辑器(CPE)系统在人类细胞系中同时编辑多达四个基因。[6]
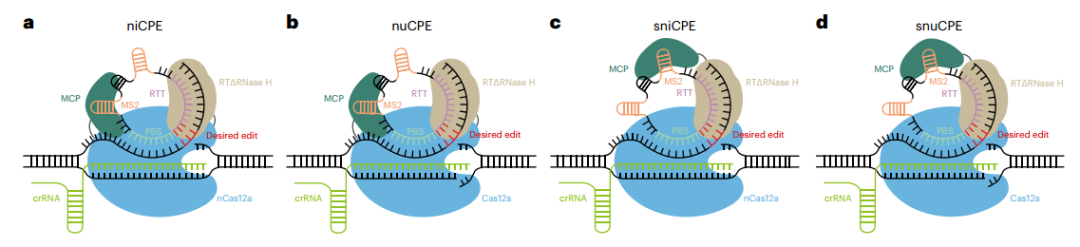
图2基于Cas12a和环状RNA的CPE系统。[6]
基因组修饰
基于基因编辑系统的基因组表观修饰技术,不引入基因组疤痕(无插入、替换和删除序列),可更安全地调节基因表达。例如,对特定基因位点进行甲基化修饰,可使靶内源基因表观遗传沉默;进行去甲基化,则激活基因转录。
表达DNA甲基转移酶DNMT3A-3L和ZF-KRAB融合蛋白的circRNA,可在12天内有效抑制与心血管疾病风险有关的PCSK9的表达。类似地,利用circRNA表达CRISPRoff系统的核酸酶失活Cas9(dCas9)、KRAB、DNMT3A-3L融合蛋白,也可在sgRNA的引导下特异性抑制B2M基因。[5]
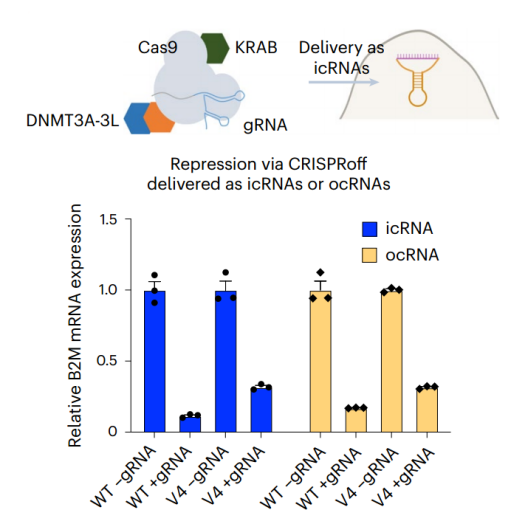
图3将表达CRISPRoff WT或变体V4的环状icRNA和ocRNA,以及靶向B2M基因的sgRNA递送到HEK293T细胞。[5]
03 肿瘤免疫
肝外靶向的GSer-CARTs递送表达肿瘤抗原卵清蛋白(OVA)的circ-OVA,能在小鼠模型体内诱导强烈的T细胞反应,且能强效、安全、稳定抑制肿瘤生长,甚至清除肿瘤。[7]
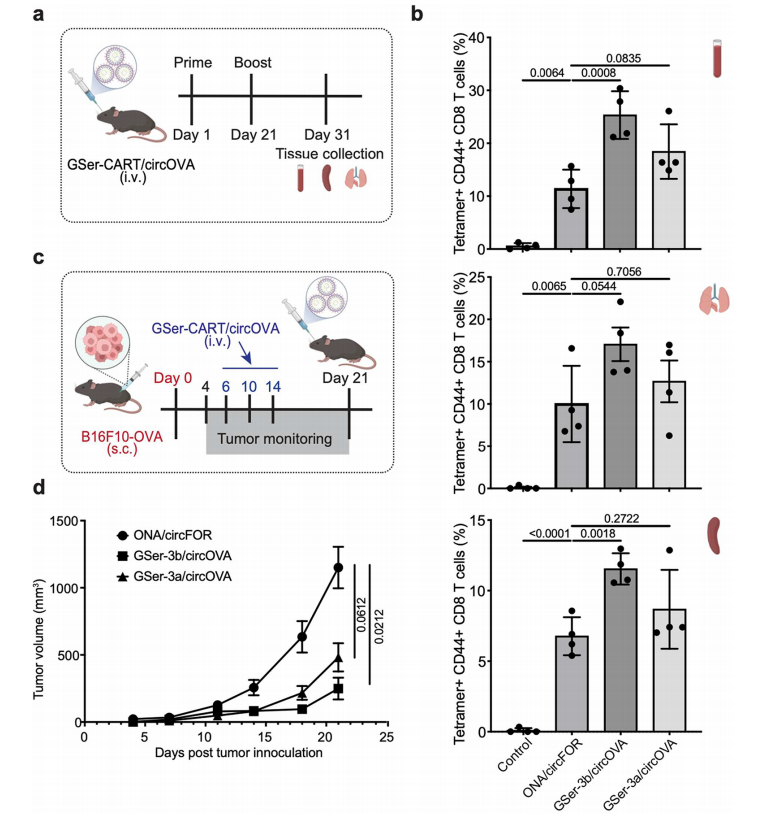
图4 GSer-CART/circOVA复合物可引起较强的抗肿瘤反应,抑制肿瘤生长。[7]
LNP递送表达三个重复的肿瘤新抗原PTPN2多肽片段的circRNA,在小鼠体内能稳定、持久(持续11天以上,线性mRNA只能持续9天)表达抗原蛋白,有效刺激强大的抗肿瘤免疫反应,显著抑制肿瘤生长,整体效果优于线性mRNA,且无明显副作用。[8]
在Lewis肺癌模型中,针对特定肿瘤定制的LNP递送编码白细胞介素-12(IL-12)的circRNA,诱导了强大的免疫反应,导致明显的肿瘤消退。[9]
利用circRNA编码溶瘤内源分子GSDMDENG的蛋白,可激活线粒体裂解特性并诱导小鼠抗肿瘤免疫,显著抑制胰腺、肺和结肠腺癌的发生。[10]
04 CAR-T/TCR-T
基于circRNA的CAR-T疗法可避免传统技术的病毒载体、基因组整合和永久转基因表达所带来的风险,且相比线性mRNA更稳定、表达半衰期更长和免疫原性更低。
相比线性mRNA,表达anti-CD19 CAR的circRNA在小鼠体内,蛋白表达水平和活性明显更高且更稳定,细胞毒性更强,诱导相关细胞因子释放水平更高,具有更优越的抗肿瘤功效。[11]
基于circRNA技术可实现体内CAR-T疗法,无需分离患者体内T细胞进行编辑、扩增、再回输,相比体外CAR-T细胞疗法,具有成本低、便捷、现货、无需骨髓清除、可重复使用且无基因组整合风险等优势。利用免疫细胞趋向性的LNP体内递送编码anti-HER2 CAR蛋白的circRNA至模型小鼠体内,可显著抑制肿瘤生长,并诱导促炎症肿瘤微环境,联合肿瘤疫苗还可协同增强抗肿瘤活性。[12]
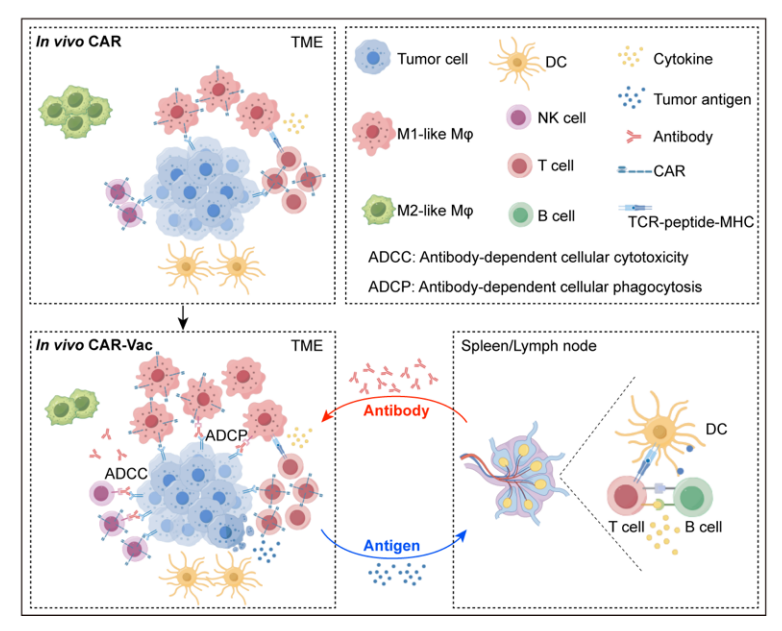
图5体内协同CAR-VAC免疫治疗机制。[12]
与CAR-T细胞类似,T细胞受体工程化T细胞(TCR-T)也是一类经工程化改造的T细胞。递送编码CMV-pp65抗原的环状RNA到树突状细胞(moDCs)中,相比线性mRNA,能更加持久地提供抗原信号,更加高效地激活和扩增CMV-pp65特异性T细胞。[13]
05 蛋白替代
类似上述RiboX开发表达水通道蛋白AQP1的LNP-circRNA药物,利用circRNA持续长效表达功能性蛋白,有利于功能性蛋白的积累及发挥功效。
血管内皮生长因子(VEGF)在糖尿病足(DFU)的血管生成和促进创面愈合中起重要作用。然而,VEGF稳定性差,易于降解,难以持续输送到创面部位并发挥药理活性。而单剂U-LNP/VEGF-A circRNA制剂及可原位长效表达和释放VEGF-A,第12天即可使糖尿病小鼠创面几乎完全愈合,效果显著优于线性VEGF-A mRNA和rhVEGF。[14]
此外,利用LNP递送表达NGF的circRNA,可显著提高视网膜神经节细胞的存活率,效果远优于重组NGF蛋白治疗。[15]
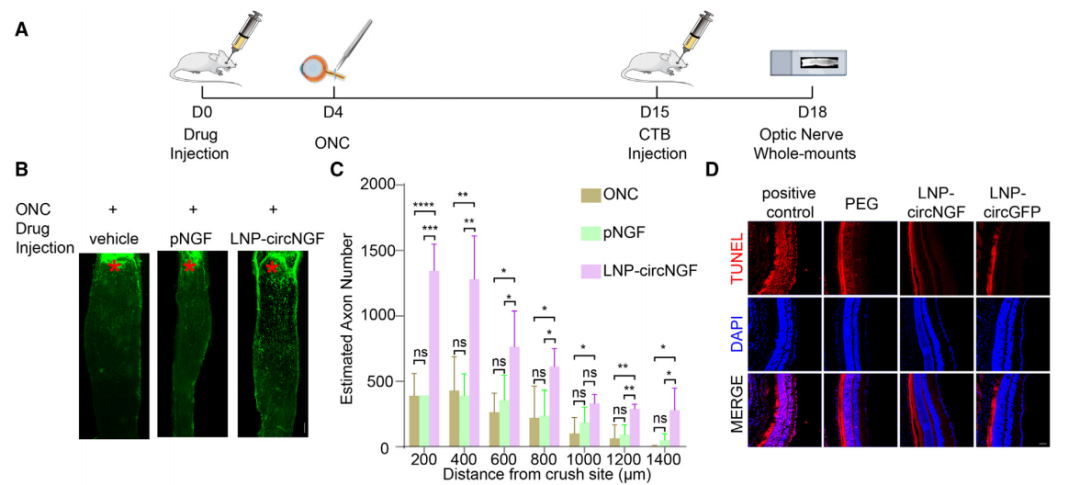
图6基于环状RNA的NGF治疗的神经保护作用。[15]
利用可电离甘油脂质(TG6A)将编码FGF18蛋白的circRNA递送到间充质干细胞(MSC)中,可显著促进大鼠OA模型软骨修复。[16]
06 传染病治疗
circRNA在血液中同样具有较高的稳定性,作为传染病疫苗可提供强大的保护。此外,circRNA药物具有快速开发和大规模生产的优势,可快速有效应对爆发和传播迅速的传染性疾病。
表达SARS-CoV-2 S蛋白的三聚体RBD的circRNA疫苗,诱导有效的中和抗体和T细胞免疫反应,在小鼠和恒河猴中提供针对变种SARS-CoV-2的强大保护。[17]
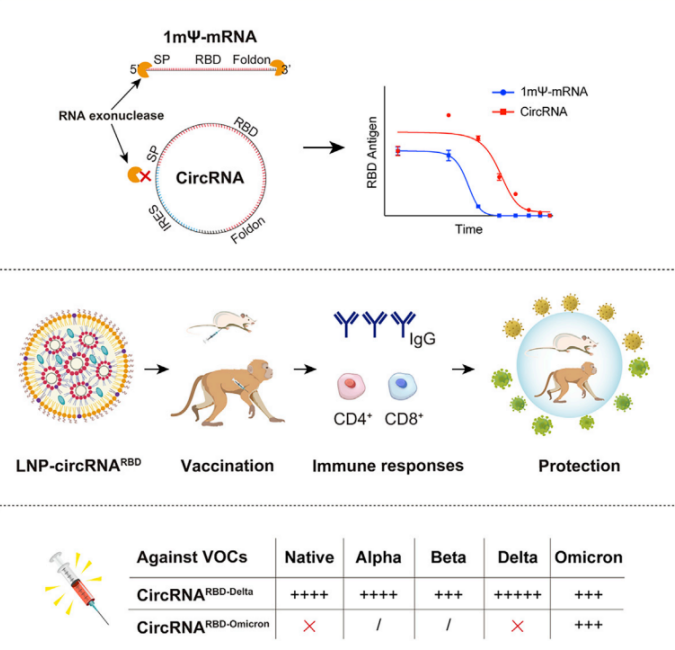
图7对抗SARS-CoV-2的circRNA疫苗。[17]
混合多种表达猴痘病毒不同抗原的circRNA,可触发针对猴痘疫苗的有效保护。[18]
分别表达寨卡病毒(ZIKV)两种抗原的LNP-circRNA经过优化后,单剂量即可在小鼠体内提供有效和持久的保护作用,而不会诱导明显的登革热抗体依赖性增强效应。[19]
黄病毒(JEV)RNA可以复制并隐藏在ER相关膜结构中,circRNA表达修饰的Cas13以靶向ER(erCas13),在sgRNA的引导下,可显著降低黄病毒感染水平,且与mRNA相比,可翻译更多的erCas13,具有更好的抗病毒活性。[20]
自我扩增mRNA(SAM)疫苗较少剂量(与线性mRNA相比)即可在较长时间内产生所需数量的抗原,从而产生强烈、持久的免疫反应。然而,SAM RNA也存在序列较长、可能引入突变、免疫原性较高、作用机制不稳定等问题。相比SAM,更安全地表达SARS-CoV-2-RBD抗原的circRNA疫苗诱导的TH1偏向性细胞免疫反应明显更高、更持久,并提供更有效的保护。[21]
07 细胞工程
表达相关分化因子的circRNA,可用于诱导多功能干细胞定向分化。H1人类多能干细胞(hPSC)中单次转染表达NEUROD1的circRNA,可在1周内分化为神经元。[5]
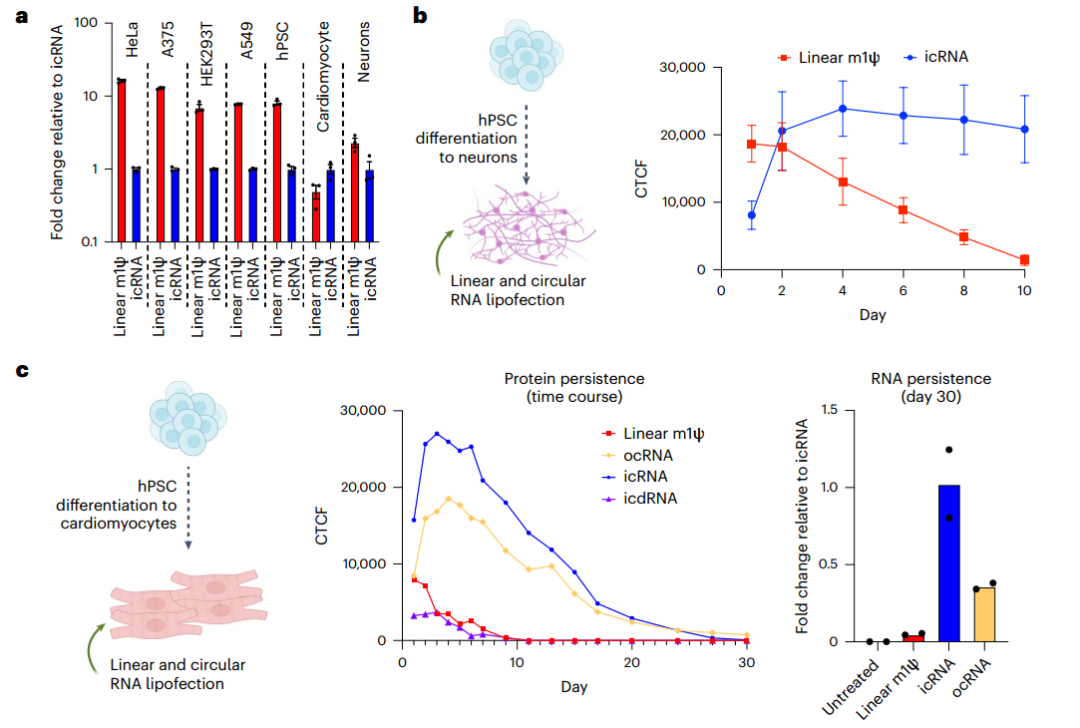
图8表达NEUROD1的circRNA更有效促进hPSC分化为神经元。[5]
08 核酸适配体
适配体是细胞中表达的短结构DNA或RNA,用于结合特定靶标并操纵细胞内过程。设计特殊三维结构的circRNA可作为适配体,如抗体一般高亲和力、特异性结合蛋白,用于捕获或隔离目标分子。
腺相关病毒(AAV)递送具有短双链结构的circRNA(ds-cRNA)适配体到神经元和小胶质细胞中,能够安全且有效抑制过度激活的蛋白激酶R(PKR),实现对阿尔茨海默病小鼠的神经保护、增强其空间学习和记忆能力。[22]
类似地,靶向脾脏的LNP递送ds-cRNA适配体,可实现PKR异常激活相关的炎性疾病小鼠模型银屑病的干预治疗。[23]
09 反义circRNA
CircRNA可通过与互补的RNA或DNA直接碱基配对,调节基因的表达。已经开发出反义环状RNA(AS-circRNAs),通过靶向病毒基因组RNA结构保守的5'UTR,抑制SARS-CoV-2的复制,相比修饰的线性AS-RNA,表现出更强的抗病毒功效。[24]
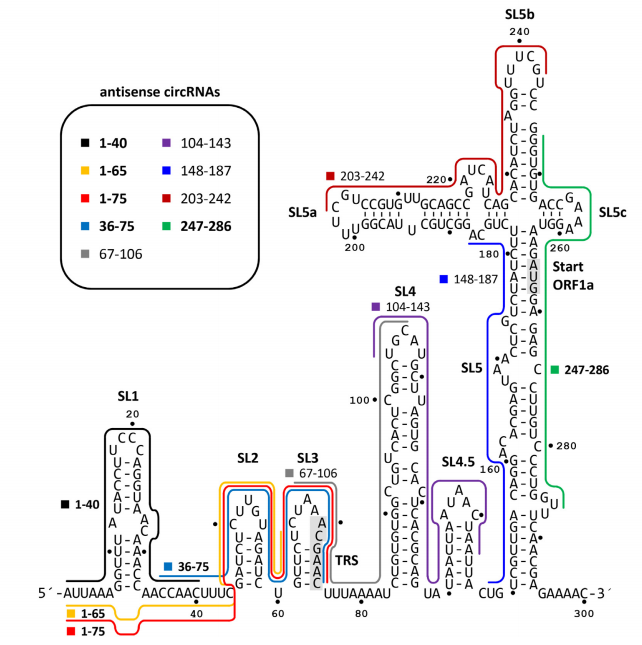
图9靶向SARS-CoV-2 RNA的AS-circRNA设计。[24]
10 模拟天然circRNA
内源性circRNA在生物体内可作为miRNA分子海绵、蛋白支架,与DNA互作调控转录,翻译蛋白或多肽等机制调控基因表达。制备工程化天然circRNA模拟物,递送至体内实现特定circRNA的表达,可发挥其体内的功能。
circCDK13可形成circCDK13-IGF2BP3-mRNA复合物,稳定并上调CD44和c-MYC的表达。含高丰度circCDK13的工程化EV,能促进糖尿病小鼠模型的伤口愈合。[25]
在脓毒症小鼠的巨噬细胞中,circRNA SCAR表达下调,与M1过度极化有关。利用外泌体装载circRNA SCAR递送到巨噬细胞线粒体中,可在脓毒症小鼠模型体内减轻全身炎症。[26]
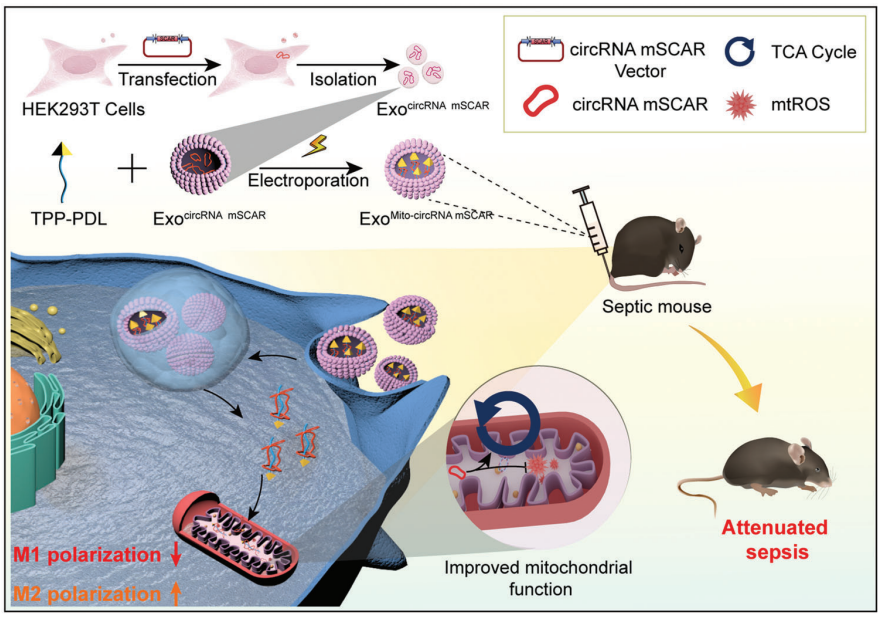
图10外泌体装载circRNA SCAR减轻脓毒症小鼠模型炎症的机制。[26]
11 生物传感器
利用circRNA的环状结构特点,还可以开发生物传感器。基于CRISPR系统设计环状crRNA,可抑制Cas12a切割位点特异性双链DNA和非特异性单链DNA。核酸酶(NAzymes)可使环状crRNA切割成线性,从而激活CRISPR-Cas12a。利用这原理开发的NA3C策略通过检测尿路感染患者尿液中大肠杆菌反应性RNA切割DNAzyme,从而高特异性(90%)、高灵敏度(100%)临床评估尿路感染。[27]
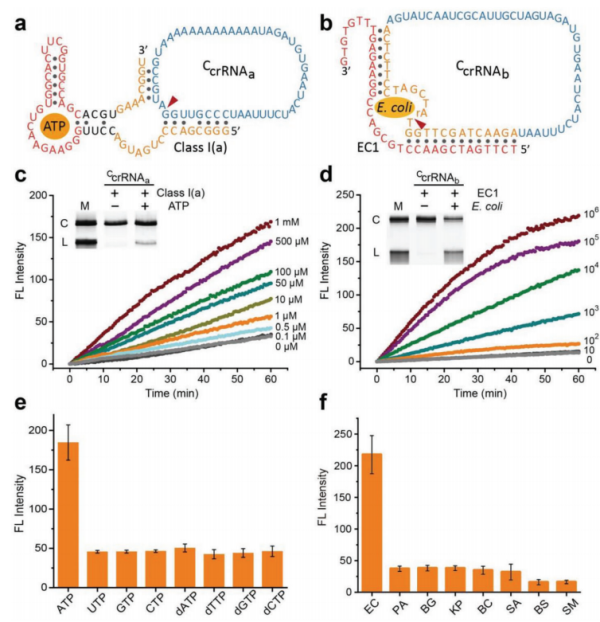
图11 NA3C用于ATP和大肠杆菌检测。[27]
Tornado表达的circRNA编码基于RNA的荧光传感器,在结合活细胞中的小分子后,产生的荧光强度是线性传感器的近200倍。[28]
12 miRNA分子海绵
体外合成的circRNA海绵是一种潜在的治疗策略,可靶向病理积累的miRNA。引入体外合成或异位表达的含有部分而非全部与miRNA互补结合位点的稳定circRNA,可降低细胞中与疾病相关的miRNA活性。
miRNA-122可与丙型肝炎病毒(HCV)RNA的5’端结合,保护HCV RNA免受核外解降解,从而增强病毒在肝细胞中的复制和翻译。利用设计circRNA分子海绵,功能性隔离miRNA-122,可更高效抑制病毒蛋白产生。[29]
13 蛋白分子海绵
类似部分circRNA在体内的作用机制,工程化circRNA也可设计作为蛋白分子海绵,以隔离病理性蛋白。
lncRNA NORAD可抑制Pumilio(PUM)蛋白参与细胞周期调节的mRNA编码因子,防止异常有丝分裂。设计多达8个PUM相应元件(PRE)的circRNA,可加强NORAD-PUM细胞体的形成,很大程度上挽救NORAD缺失的HCT116细胞中的染色体分离缺陷。[30]
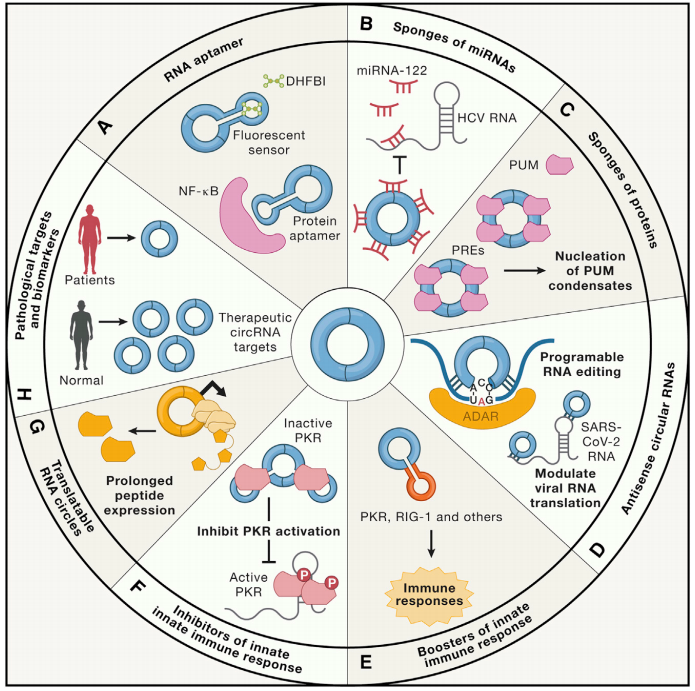
图12基于circRNA的生物医学应用。[31]
以上,是否有你Pick的应用领域呢?工程化体外合成平台给予了circRNA更辽阔的未来,更明亮的前景。circRNA的应用仍在不断开发中,敬请期待……!!!
参考资料
[1]https://www.prnewswire.com/news-releases/ribox-therapeutics-announces-fda-clearance-for-ind-application-of-rxrg001-the-first-circular-rna-therapy-for-the-treatment-of-radiation-induced-xerostomia-and-hyposalivation-302287539.html
[2]Lin Y,et al.Integrinα6-containing extracellular vesicles promote lymphatic remodelling for pre-metastatic niche formation in lymph nodes via interplay with CD151.J Extracell Vesicles.2024,13(10):e12518.doi:10.1002/jev2.12518.PMID:39329462;PMCID:PMC11428163.
[3]Yi,Z.et al.Engineered circular ADAR-recruiting RNAs increase the efficiency and fidelity of RNA editing in vitro and in vivo.Nat.Biotechnol.2022,40,946–955.[4]Schartel L,et al.Selective RNA pseudouridinylation in situ by circular gRNAs in designer organelles.Nat Commun.2024,15(1):9177.
[5]Tong M,et al.Robust genome and cell engineering via in vitro and in situ circularized RNAs.Nat Biomed Eng.2024.
[6]Liang R,et al.Prime editing using CRISPR-Cas12a and circular RNAs in human cells.Nat Biotechnol.2024.
[7]Li Z,et al.Organ-and Cell-Selective Delivery of mRNA In Vivo Using Guanidinylated Serinol Charge-Altering Releasable Transporters.J Am Chem Soc.2024,146(21):14785-14798.
[8]Wang F,et al.Circular RNA-based neoantigen vaccine for hepatocellular carcinoma immunotherapy.MedComm(2020).2024,5(8):e667.
[9]Xu S,et al.Tumor-Tailored Ionizable Lipid Nanoparticles Facilitate IL-12 Circular RNA Delivery for Enhanced Lung Cancer Immunotherapy.Adv Mater.2024,36(29):e2400307.
[10]Feng,Z.et al.An in vitro-transcribed circular RNA targets the mitochondrial inner membrane cardiolipin to ablate EIF4G2+/PTBP1+pan-adenocarcinoma.Nat.Cancer.2024,5,30–46.
[11]Hu Q,et al.Scarless circular mRNA-based CAR-T cell therapy elicits superior anti-tumor efficacy.bioRxiv.2024.
[12]Wang Y,et al.Synergically enhanced anti-tumor immunity of in vivo CAR by circRNA vaccine boosting.bioRxiv.2024.
[13]Shen L,et al.Circular mRNA-based TCR-T offers a safe and effective therapeutic strategy for treatment of cytomegalovirus infection.Mol Ther.2024,32(1):168-184.[14]Liu J,et al.A single dose of VEGF-A circular RNA sustains in situ long-term expression of protein to accelerate diabetic wound healing.J Control Release.2024,373:319-335.
[15]Jiang W,et al.Circular RNA-based therapy provides sustained and robust neuroprotection for retinal ganglion cells.Mol Ther Nucleic Acids.2024,35(3):102258.[16]Huang K,et al.FGF18 encoding circular mRNA-LNP based on glycerolipid engineering of mesenchymal stem cells for efficient amelioration of osteoarthritis.Biomater Sci.2024,12(17):4427-4439.
[17]Qu L,et al.Circular RNA vaccines against SARS-CoV-2 and emerging variants.Cell.2022,185(10):1728-1744.e16.
[18]Zhou J,et al.Circular RNA vaccines against monkeypox virus provide potent protection against vaccinia virus infection in mice.Mol Ther.2024,32(6):1779-1789.
[19]Liu X,et al.A single-dose circular RNA vaccine prevents Zika virus infection without enhancing dengue severity in mice.Nat Commun.2024,15(1):8932.
[20]Su CI,et al.A cis-acting ligase ribozyme generates circular RNA in vitro for ectopic protein functioning.Nat Commun.2024,15(1):6607.[21]Singh O N,et al.Immunogenicity and protection efficacy of self-amplifying and circular mRNA vaccines for SARS-CoV-2.bioRxiv.2024.
[22]Feng X,et al.Circular RNA aptamers ameliorate AD-relevant phenotypes by targeting PKR.bioRxiv.2024.
[23]Guo SK,et al.Therapeutic application of circular RNA aptamers in a mouse model of psoriasis.Nat Biotechnol.2024.
[24]Pfafenrot,C.et al.Inhibition of SARS-CoV-2 coronavirus proliferation by designer antisense-circRNAs.Nucleic Acids Res.2021,49,12502–12516.
[25]Huang Q,et al.circCDK13-loaded small extracellular vesicles accelerate healing in preclinical diabetic wound models.Nat Commun.2024,15(1):3904.
[26]Fan L,et al.Exosome-Based Mitochondrial Delivery of circRNA mSCAR Alleviates Sepsis by Orchestrating Macrophage Activation.Adv Sci(Weinh).2023,10(14):e2205692.[27]Wu Y,et al.Nucleic Acid Enzyme-Activated CRISPR-Cas12a With Circular CRISPR RNA for Biosensing.Small.2023,19(41):e2303007.
[28]Litke,J L,and Jaffrey,S.R..Highly efficient expression of circular RNA aptamers in cells using autocatalytic transcripts.Nat.Biotechnol.2019,37,667-675.[29]Jost,I,et al.Functional sequestration of microRNA-122 from hepatitis C virus by circular RNA sponges.RNA Biol.2018,15,1032-1039.[30]Elguindy,M M,et al.NORAD-induced Pumilio phase separation is required for genome stability.Nature.2021,595,303-308.Liu CX,Chen LL.Circular RNAs:Characterization,cellular roles,and applications.Cell.2022,185(13):2390.









