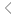- 首页
- >
- GENESEED
- >
超长、超短序列circRNA合成有多难?!
circRNA应用新研究正在不断推出,有利用circRNA表达NGF治疗视网膜神经退行性疾病[1],表达VEGF-A治疗糖尿病足溃疡[2],表达CAR蛋白或肿瘤抗原治疗肿瘤[3-4],表达猴痘病毒抗原预防猴痘病毒[5],表达Cas13蛋白抵抗RNA病毒[6],circRNA作为适配体治疗银屑病[7]……有点让人目不暇接了,可见circRNA已由一颗生物医药研究届的新星升为炙热之星!

技术革新开拓科研思路,技术瓶颈突破推动研究发展。各大科研团队对circRNA体外制备的策略创新,为推进环状RNA的成药作出贡献。但超长和超短序列的circRNA的合成似乎仍个难点,这极大限制了circRNA的应用范围。
比如近年来,利用mRNA表达Cas 9蛋白发挥CRISPR系统功能的研究陆续有报道,mRNA的不稳定性仍然是该应用推广主要的限制因素;然而,利用circRNA表达Cas 9蛋白仍鲜有报道,可能就是由于Cas 9蛋白分子量较大,其对应超长circRNA合成和LNP包封难度较大。
那么超长、超短序列的circRNA合成究竟有多难?!
01超长circRNA序列合成难点
① 高质量模板是IVT RNA的关键,而序列越长,质粒构建过程发生突变的概率越高,出现的突变位点越多,修复起来也非易事。② 随着IVT circRNA长度的增加,线性前体RNA两端形成双链RNA(dsRNA)和二级结构的可能性也增加,显著降低了末端连接的效率。③ 添加寡核苷酸辅助夹板可防止线性前体RNA末端二级结构的形成,但夹板片段的引入增加了目标产物纯化和回收的难度。④ 线性前体RNA的环化是熵变不利的过程,而序列越长,熵变会越不利,反应效率会变得更低。⑤ 当增加线性前体RNA浓度以提高反应效率,会增加分子间连接的副反应,严重影响目标产物的产量。
02超短circRNA序列合成难点
① 超短序列产生的弯曲应力更高,使分子间连接产生多聚体的副反应比分子内环化反应更容易发生,最终导致目标产物产量下降。
② 为减少副反应使反应物浓度下降,则会导致反应效率下降。③ 针对夹板法环化而言,需要设计更短的夹板,但仍解决不了分子间连接产生多聚体的副反应问题。
然而,超长、超短序列circRNA可大有用途!
01超长序列
① 表达CRISPR系统的Cas蛋白,特别是常用但分子量较大的Cas9蛋白。超长序列circRNA的稳定、高质量合成可推进circRNA在CRISPR系统的应用。② 表达其它分子量较大的蛋白,如融合蛋白,以及研究热点的双靶CAR实现基于circRNA的双靶CAR-T治疗。
相关研究1
Su等(2024)利用circRNA表达添加靶向ER修饰的Cas13显示出优越的抵抗RNA病毒的活性。[6]
考虑到黄病毒RNA可以复制并隐藏在ER相关膜结构中,研究团队通过circRNA表达修饰的Cas13以靶向ER (erCas13)。单独递送erCas13 circRNA显示出基础抗病毒活性,未递送RNA组的GFP(+)率达到~81%时,erCas13 circRNA将病毒感染抑制至GFP(+)率低约63%。添加sgRNA, erCas13 circRNA可以进一步抑制感染,将病毒感染降低至~45% GFP(+)。转染erCas13 线性mRNA或circRNA后,都持续出现一定水平的抗病毒活性。然而,与mRNA相比,erCas13 circRNA可以翻译更多的erCas13,以帮助sgRNA获得更好的抗病毒活性。

图1 f:环状RNA编码ER靶向Cas13的设计示意图。g:N18细胞共转染DNA编码erGFP的质粒和编码flag标记Cas13或erCas13的circRNA。h-j:用mRNA或circRNA形式的erCas13 RNA处理N18细胞,并感染JEV-GFP,然后按特定的时间和剂量加入sgRNA。i:RNA电泳显示使用的mRNA和circRNA。j:48 h (erCas13 RNA转染66 h)流式细胞术分析N18细胞。
02超短序列
① 作为CRISPR系统的gRNA、crRNA,发挥更稳定、更持久、更安全的功能;② 发挥短序列核酸适配体的功能;③ 作为短序列天然RNA表达,研究其功能机制,或在体内发挥相应的功能;④ 作为其它超短序列RNA发挥作用。
相关研究2
Wu等(2023)将核酸酶激活的CRISPR- Cas12a与环状CRISPR RNA用于生物传感。[8]环状结构的CRISPR RNA (crRNA)抑制Cas12a对位点特异性双链DNA切割和非特异性单链DNA反式切割。具有RNA切割活性的核酸酶(NAzymes)可以使环状crRNA线性化,从而激活CRISPR-Cas12a功能。研究利用配体响应核酶和DNAzymes作为分子识别元件,证明了环状crRNA靶向线性化为生物传感提供了极大的多功能性。这种策略被称为“NAzyme-Activated CRISPR- cas12a with Circular CRISPR RNA (NA3C)”。研究使用NA3C对尿路感染进行临床评估,检测40例患者尿液样本中大肠杆菌反应性RNA切割DNAzyme,诊断灵敏度为100%,特异性为90%。

图2 NA3C用于ATP和大肠杆菌检测。
相关研究3
Liang等(2024)把多个crRNA置于circRNA中,开发基于Cas12a的引导编辑器,可有效同时编辑多个基因。[9]研究将靶向不同位点的多个crRNA,以及靶向多个位点的RTT-PBS序列串联在circRNA中。实验结果表明,该设计可实现双基因、三基因甚至四基因的高效引导编辑。进一步验证结果表明CPE具有优良的特异性,几乎没有检测到脱靶效应。低脱靶效应、高编辑效率的CPE系统为利用各种核酸酶开发为新型引导编辑系统提供了范例,多类型的CPE系统在生物研究、疾病治疗和作物育种等多场景中将发挥巨大的潜力。

图3 不同形式CRISPR-Cas12a 编辑器示意图。
相关研究4
Guo等(2024)利用环状RNA适配体治疗银屑病小鼠模型。[7]RNA适体是一种新的治疗方式,但受到其易降解和免疫原性的限制。研究团队在前期工作中,证明了短双链环状RNA (ds-cRNAs)具有极小的免疫原性,且靶向dsRNA活化的蛋白激酶R (PKR)。研究发现通过脂质纳米颗粒将ds-cRNA递送到脾脏会减弱所检测的脾细胞中的PKR活性,导致表皮厚度减少。研究表明环状RNA作为适配体,可以减轻PKR的过度激活,达到治疗目的,代表了一种有前景的疗法。

图4 EPIC(适配体)与PKR蛋白在动力学上的高亲和力。
那怎么办?不要慌!
吉赛生物基于自主知识产权的Ⅰ型内含子自剪接法No scar精准成环技术(circPrecise®),针对超长和超短序列circRNA环化进行难点突破,可制备任意序列长度的circRNA啦!同时还保证circRNA产物的高纯度、高环化率、高效表达!
Qsep检测超短(上)、超长(下)转录环化产物


Qsep检测超短(上)、超长(下)纯化后circRNA完整性>90%


参考文献
[1] Jiang W, et al. Circular RNA-based therapy provides sustained and robust neuroprotection for retinal ganglion cells. Mol Ther Nucleic Acids. 2024, 35(3):102258.
[2] Liu J, et al. A single dose of VEGF-A circular RNA sustains in situ long-term expression of protein to accelerate diabetic wound healing. J Control Release. 2024, 373:319-335.[3] Zhang X, et al. Scarless circular mRNA-based CAR-T cell therapy elicits superior anti-tumor efficacy. bioRxiv. 2024.[4] Wang F, et al. Circular RNA-based neoantigen vaccine for hepatocellular carcinoma immunotherapy. MedComm (2020). 2024, 5(8):e667.[5] Zhou J, et al. Circular RNA vaccines against monkeypox virus provide potent protection against vaccinia virus infection in mice. Mol Ther. 2024, 32(6):1779-1789.[6] Su CI, et al. A cis-acting ligase ribozyme generates circular RNA in vitro for ectopic protein functioning. Nat Commun. 2024, 15(1):6607.[7] Guo SK, et al. Therapeutic application of circular RNA aptamers in a mouse model of psoriasis. Nat Biotechnol. 2024. doi: 10.1038/s41587-024-02204-4.[8] Wu Y, et al. Nucleic Acid Enzyme-Activated CRISPR-Cas12a With Circular CRISPR RNA for Biosensing. Small. 2023, 19(41):e2303007.[9] Liang R, et al. Prime editing using CRISPR-Cas12a and circular RNAs in human cells. Nat Biotechnol. 2024 . doi: 10.1038/s41587-023-02095-x.