
- 首页
- >
- GENESEED
- >
东南大学李新松/郭宗科团队开发U-LNP/VEGF-A circRNA制剂促进糖尿病足溃疡模型创面愈合
作者:EP
校稿:李新松
糖尿病足溃疡(DFU)是糖尿病最严重的并发症之一,其特征是创面周围的微小血管或毛细血管显著受损。修复慢性不愈合的DFU创面具有挑战性。血管内皮生长因子(VEGF)在DFU的血管生成和促进创面愈合中起重要作用,是目前公认最有效的治疗性细胞因子之一。然而,由于VEGF稳定性差,易于降解,难以持续地将其输送到创面部位并发挥药理活性。
基因治疗包括DNA和RNA治疗,作为重组蛋白应用的有希望的替代方案而引起了极大的关注。DNA治疗使外源基因整合到细胞基因组中长期表达,但具有遗传变异的风险。而基于mRNA的蛋白质替代疗法具有转染效率高、无遗传变异风险、免疫原性低等诸多优点。然而,线性mRNA易降解,稳定性差,表达时间短,限制了其应用。环状RNA (circRNA)由于其共价闭合的环状结构而高度稳定,从而免受核酸外切酶介导的降解。虽然circRNA缺乏帽依赖翻译的基本要素,但可以设计成通过内部核糖体进入位点(IRES)进行蛋白质翻译,且不需要在开放阅读框(ORF)部分进行N6 -甲基腺苷(m6A)修饰。鉴于其固有的稳定性和可免除核苷酸修饰的特性,circRNA可能是替代传统蛋白质疗法更有价值的方案。
近日,东南大学李新松教授团队联合东南大学附属中大医院整形外科专家郭宗科主任团队在Journal of Controlled Release上发表文章:A single dose of VEGF-A circular RNA sustains in situ long-term expression of protein to accelerate diabetic wound healing。文章阐述了该研究团队开发的一种LNP/VEGF-A circRNA纳米剂,通过原位长效表达和释放VEGF-A,加速糖尿病足溃疡模型小鼠的创面愈合,可能成为一种有前景的DFU治疗药物(已申请发明专利)。

一、 VEGF-A circRNA的合成与验证
研究团队采用I型内含子自催化策略合成VEGF-A circRNA。同时制备1mΨ修饰或无修饰线性mRNA用作对比实验。VEGF-A circRNA的环状结构和纯度经过RNase R、RNase H、RT-PCR和Sanger测序验证,其表达能力也通过Western Blot检测转染VEGF-A circRNA的人脐静脉内皮细胞(HUVECs)中的VEGF-A而得到验证。(图1)
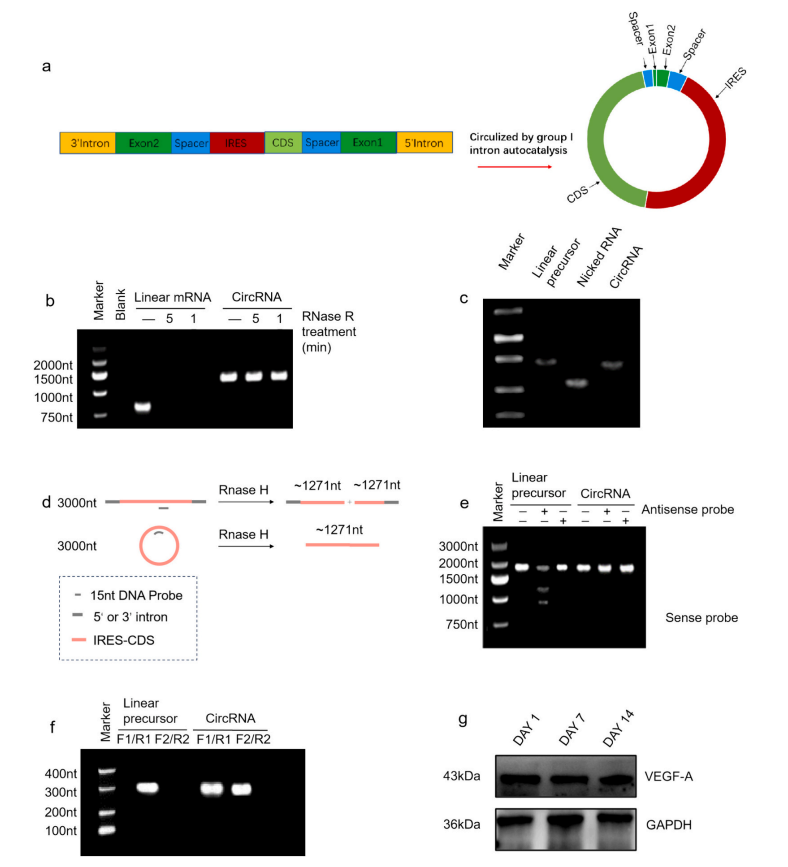
图1 circRNA环化和纯化的验证步骤。
二、 U-LNP/VEGF-A circRNA的包封与表征
体内成像筛选的初步数据证实,U-105的LNP具有很强的转染能力。因此,研究采用可电离脂质为U-105(具有两个叔胺和两个羟基)的LNP包封配方,同时也采用了商业化的可电离脂质ALC-0315的LNP进行对比实验。动态光散射(DLS)、透射电子显微镜(TEM)、RiboGreen试剂和2-(对甲苯胺)-6-萘磺酸(TNS)分别表征U-LNP/VEGF-A circRNA。结果显示其平均直径为108.51 nm,多分散性指数(PDI)为0.21,Zeta电位为-3.31 mV;TEM观察U-LNP为球形结构,直径约为100 nm;包封效率约为87.12%;pKa值约为6.65。U-LNP/ VEGF-A circRNA的包封与其它配方无显著差异。(图2)
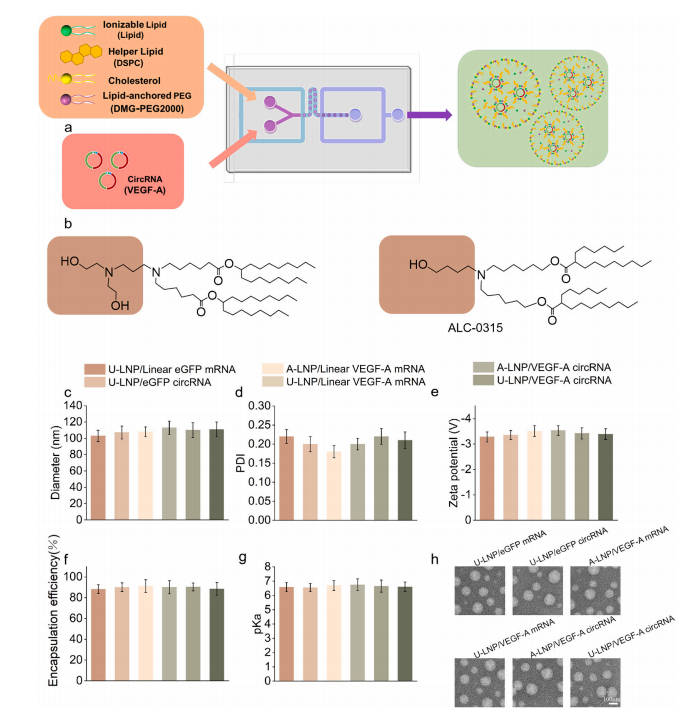
图2 U-LNP/VEGF-A circRNA的包封与表征
三、U-LNP/VEGF-A circRNA的体外长效表达
研究发现在4°C、25°C和37°C保存不同时间的VEGF-A circRNA都比线性VEGF-A mRNA更稳定。相比线性mRNA组,circRNA组的VEGF-A表达水平明显更高,且高表达持续时间更长。此外,U-105 LNP对RNA的保护和递送效率比ALC-0315 LNP更佳。结果表明,U-LNP/VEGFA circRNA可以被传递到细胞中,并持续高水平表达蛋白质,性能更好。(图3)
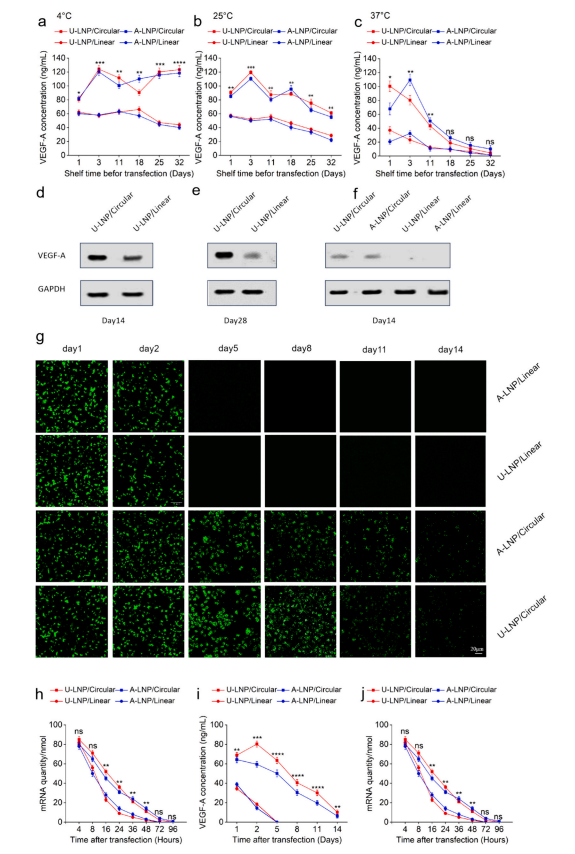
图3 U-LNP/VEGF-A circRNA的体外长效表达。
四、 U-LNP/VEGF-A circRNA的溶酶体逃逸及体外生物相容性
有效递送RNA的LNP载体必须从溶菌酶逃逸。此外,细胞毒性也是评价LNP载体的重要标准。溶酶体逃逸和CCK8实验验证了U-LNP/circRNA能成功逃逸溶酶体,且没有细胞毒性。U-LNP/VEGF-A circRNA处理的HUVECs细胞增殖率明显高于裸circRNA组,这可能与溶酶体逃逸以及VEGF-A的表达有关。(图4a-e)
通常RNA制剂的先天免疫反应是由未修饰的mRNA上调相关细胞因子引发的,而1mΨ修饰mRNA可改善这情况。为对比circRNA制剂与线性mRNA的免疫原性,采用qPCR法检测各种制剂处理的HUVECs上清液中相关细胞因子的表达,发现circRNA组和1mΨ修饰mRNA组的免疫反应率都远低于未修饰的线性mRNA组;U-LNP/VEGF-A circRNA诱导的先天免疫反应略弱于A-LNP/VEGF-A circRNA。这证实circRNA与1mΨ修饰mRNA具有相似的生物相容性,U-105 LNP表现优于ALC-0315 LNP。(图4f)
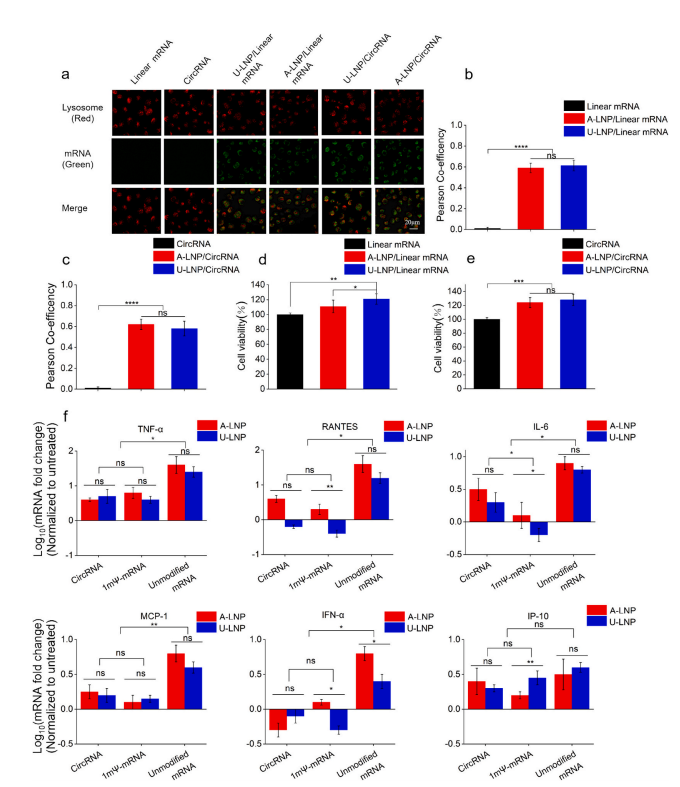
图4 U-LNP/VEGF-A circRNA的溶酶体逃逸及体外生物相容性。
五、体外验证U-LNP/VEGF-A circRNA对细胞增殖、迁移和血管形成的影响
细胞增殖和迁移是血管生成和纤维生成的基础,是决定创面愈合的重要因素。通过体外实验验证了U-LNP/VEGF-A circRNA可以连续且显著地翻译成激活内皮细胞增殖、迁移和血管形成的VEGF-A,促进细胞增殖、迁移和血管形成,且效果优于线性mRNA,U-105 LNP效果略优于ALC-0315 LNP。因此,VEGF-A circRNA可能在DFU创面愈合中发挥重要作用。(图5)
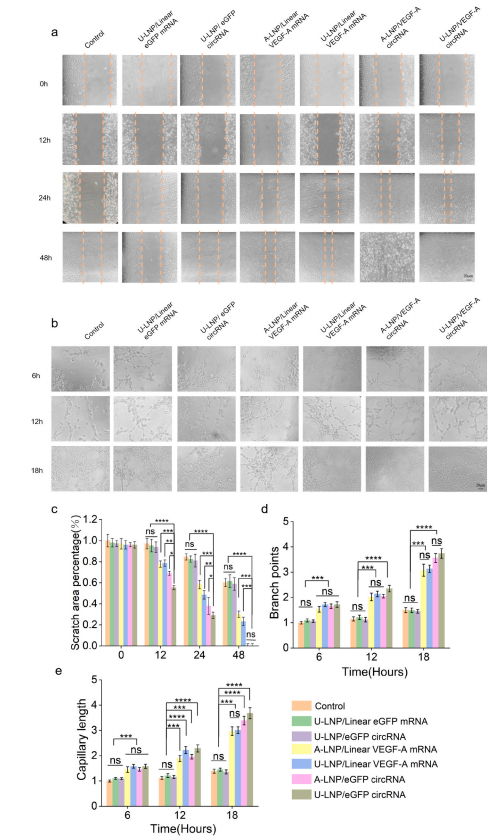
图5 体外验证U-LNP/VEGF-A circRNA对细胞增殖、迁移和血管形成的影响。
六、U-LNP/circRNA对创面愈合的原位长效作用
U-LNP/circRNA对C57BL/6糖尿病模型创面治疗效果显著优于A-LNP组、线性mRNA组或裸circRNA组。研究还设置了rhVEGF蛋白组作为对比。结果显示,rhVEGF可以促进正常小鼠的创面愈合,但对糖尿病小鼠的愈合没有明显促进作用,可能由于其在糖尿病创面微环境下快速降解,导致作用持续时间太短。与rhVEGF组相比,U-LNP/VEGF-A circRNA对糖尿病小鼠创面愈合的影响显著改善。
治疗期间各组血糖无明显差异,治疗后的糖尿病小鼠的心、肝、脾、肺、肾均无明显损伤,且创面周围皮肤炎症相关因子水平无显著差异,证明U-LNP/VEGF-A circRNA在体内无明显毒性,且免疫原性较低。综上所述,U-LNP/VEGF-A circRNA因其显著修复效果、持续表达生长因子和低毒性而表现出独特的优势。(图六)
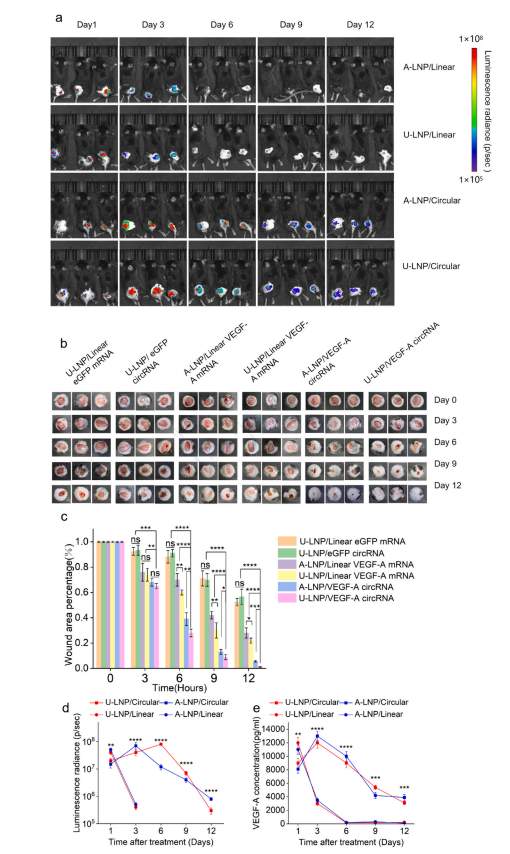
图6 U-LNP/circRNA对创面愈合的原位长效作用。
七、创面愈合的组织学分析
组织学分析表明,U-LNP/VEGF-A circRNA处理组显著增加了糖尿病模型创面周围组织的肉芽组织的厚度,且真皮成熟胶原百分比和血管密度优于VEGF-A mRNA组。U-LNP/VEGF-A circRNA处理的糖尿病小鼠创面部位B细胞、T细胞和巨噬细胞数量无显著差异。总之,U-LNP/VEGF-A circRNA通过促进肉芽组织生成、增强胶原沉积和刺激血管生成促进糖尿病小鼠创面愈合,且免疫原性低。因此,U-LNP/VEGF- A circRNA制剂可能成为一种安全、高效的替代VEGF蛋白促进糖尿病创面愈合的DFU新药。(图七)

图7 创面愈合的组织学分析。
总结
研究采用可电离脂质U-105 LNP包封VEGF-A circRNA,成功开发了可加速DFU创面愈合的U-LNP/VEGF-A circRNA纳米剂。U-LNP/VEGF-A circRNA与线性mRNA相比稳定性更好,且可在体外和体内持久表达活性蛋白。U-LNP/VEGF-A circRNA无细胞毒性,免疫原性低。单剂U-LNP/VEGF-A circRNA处理后第12天就能使糖尿病小鼠创面几乎完全愈合,效果显著优于线性VEGF-A mRNA、rhVEGF和A-LNP/circRNA。ULNP/VEGF-A circRNA对糖尿病创面愈合的促进作用可归因于circRNA的VEGF-A的持续表达。因此,U-LNP/VEGF-A circRNA纳米剂可能是一种有临床前景的DFU创面治疗策略。
原文链接
https://www.sciencedirect.com/science/article/abs/pii/S0168365924004498?via%3Dihub









