

Polysome profiling 实验,是利用核糖体沉降系数较大的特性,用蔗糖密度梯度离心的方法分离多聚核糖体。由于核糖体是细胞里密度最高的生物大分子,一条 mRNA 上结合的核糖体越多,在蔗糖密度梯度离心时的沉降速率越快,因此结合不同数量核糖体的mRNA 通过离心在溶液中会被分开。离心结束后将蔗糖溶液由底部缓慢抽出,即可对结合有不同数量核糖体的组分进行分离,可以直观地反映细胞内翻译的状态。
Polysome profiling 是一种翻译组学的研究方法,其操作流程为先用放线菌酮或氯霉素处理样本,然后裂解细胞,离心并取上清液,之后将上清液转移至蔗糖梯度上进行超离。最后,进行核糖体检测及分离。研究人员可根据实验需要,继续做 PCR 定量分析、蛋白质提取等实验。
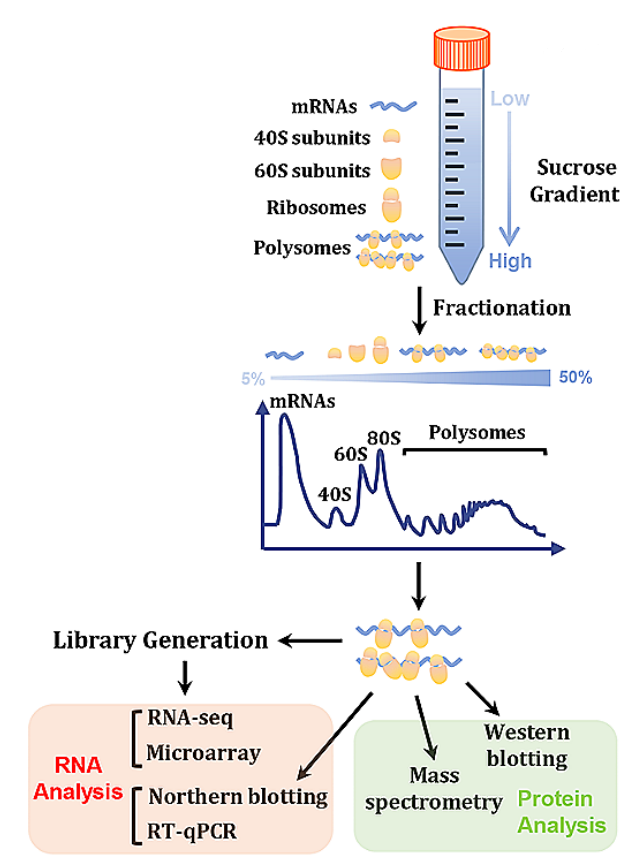
Polysome profiling实验流程概要(source:Su D, et al., 2024)
① 准确检测蛋白翻译效率;
② 分析目标RNA降解、翻译起始和抑制等机制,研究翻译调控与基因表达;
③ 挖掘潜在翻译的非常规RNA,如lncRNA、circRNA的翻译。
① 直观反映翻译状态:Polysome profiling技术能够直观地反映细胞和组织内的翻译状态,通过分析不同组分中mRNA的分布,可以了解特定mRNA的翻译活跃程度;
② 有助于理解翻译动态变化:Polysome profiling能够检测翻译中发生巨大变化的RNA,结合测序技术,有助于理解在不同生理或病理状态下翻译动态的变化。
升级版Polysome profiling plus服务内容
①增加组分:基础版Polysome profiling可根据沉降系数大小,把核糖体-RNA复合物分离成5个组分,而升级版Polysome profiling提供共18个分离的组分,可增加RT-qPCR数据点,绘制更详细的翻译动态折线图,更精准反映翻译活性的动态变化;
②增加RNA质控:检测RNA完整性,确保下游的分析。如送样不均衡,可根据质检结果进行相对等量上机(但不一定准,因为复合物含核酸和核糖体、蛋白等)
③能处理的样本类型增多:包括细胞、组织、细菌、真菌菌体等。
④统计AUC值:P/non-P ratio常用于表征样品整体的翻译活性
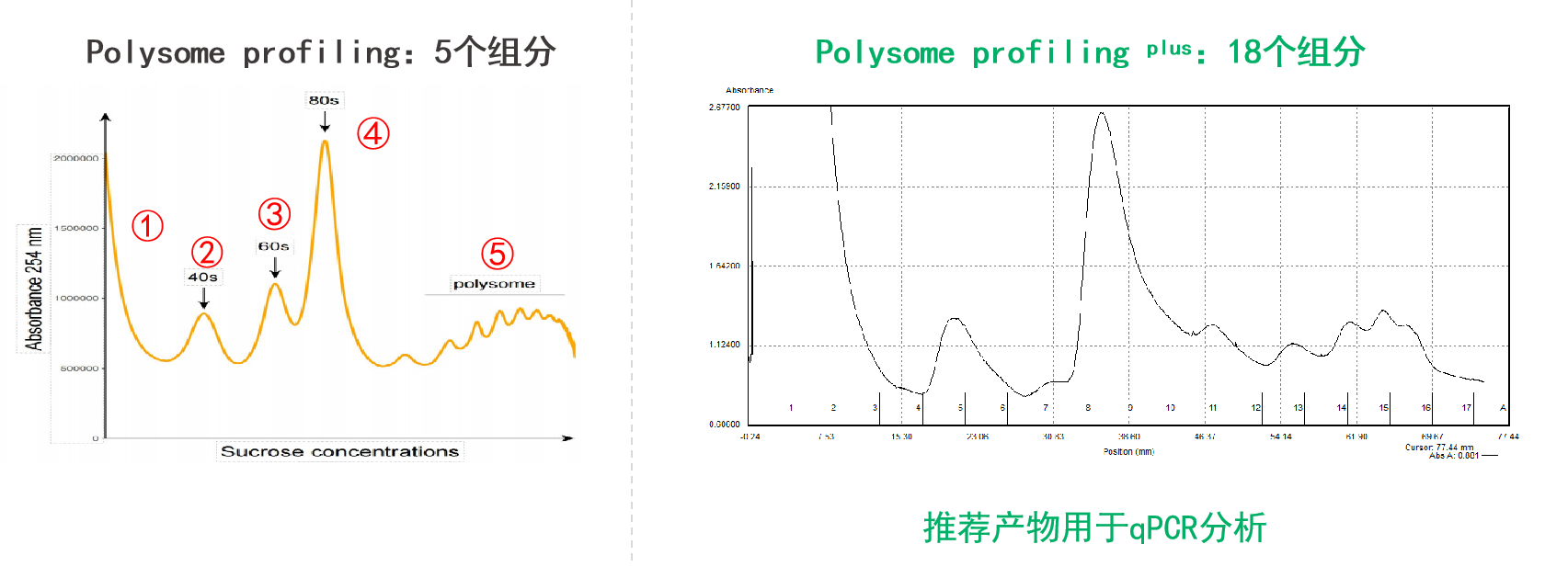
Polysome Profiling图谱示例
特点 | ||||
mRNA长度 | 全长 | 核糖体保护片段区域 | 全长 | 双核糖体保护片段区域 |
翻译中RNA回收难度 | 难 | 难 | 易 | 难 |
起始量 | 多 | 多 | 少 | 多 |
测序方法 | Microarray/NGS | NGS | Microarray/NGS | NGS |
测序长度 | 任意 | 22-35 nt | 任意 | 约54-68 nt |
检测序列变异 | √ | × | √ | × |
UTR | √ | × | √ | × |
检测核糖体位置、密度、ORF、uORF | × | √ | × | √ |
每条mRNA上核糖体数目 | √ | × | × | × |
技术难点 | 离心,梯度液分离,RNA 回收 | 酶切条件 | RNC-mRNA 易断裂 | 酶切条件 |
生理条件 | √ | √ | √ | √ |
吉赛服务项目 | 图谱(5或18组分) | Ribo-seq测序分析 | RNC-seq测序分析 | 无图谱-Disome-seq测序分析 |
图谱+RNA(5或18组分) | ||||
图谱+qPCR(5或18组分) | ||||
图谱+WB(5或18组分) | 图谱+Disome-seq测序分析 | |||
图谱+测序(组分⑤单文库) | ||||
图谱+测序(双文库-Light+Heavy组分) | ||||
图谱+测序(双文库-Free+Binding组分) |
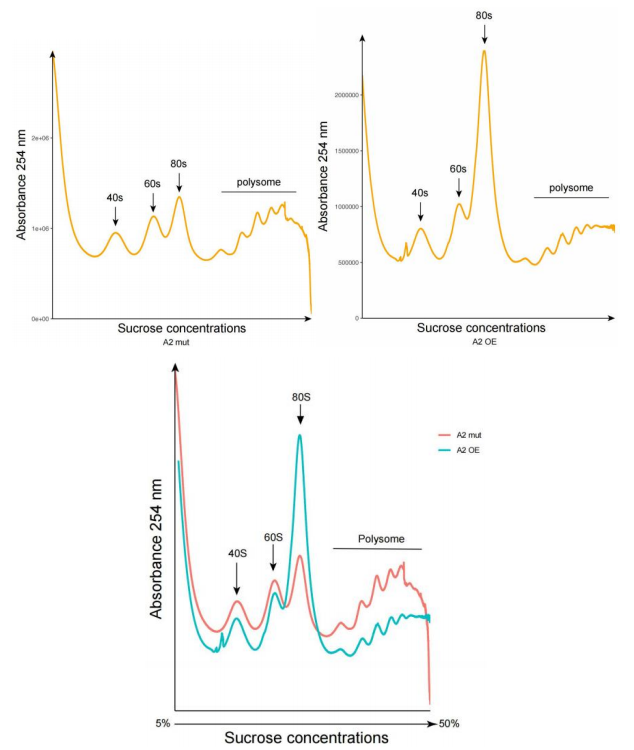
升级版Polysome profiling提供AUC值统计(P/non-P ratio),常用于表征样品整体的翻译活性
例:
样品 | 总AUC | non-Polysome | Polysome | P/non-P ratio |
A1 | 184.4 | 154.1 | 30.3 | 0.197 |
A2 | 190.2 | 159.8 | 30.4 | 0.190 |
A3 | 170.9 | 140.4 | 30.5 | 0.217 |
Polysome profiling原始样本送样建议
送样类型 | 送样量 | 备注 |
细胞(细胞数) | ≥ 1×10^7 | 无支原体污染 |
动物组织 | ≥ 300 mg |
|
植物组织 | ≥ 500 mg |
|
*具体处理、保存和运输方法请咨询技术支持。
物种范围:请咨询销售或技术支持